Paalova-Knorrova syntéza
Paalova-Knorrova syntéza je reakce umožňující přípravu furanů, pyrrolů, nebo thiofenů z 1,4-diketonů; furanové a pyrrolové skupiny jsou součástmi mnoha přírodních látek. Popsali ji v roce 1884 nezávisle na sobě němečtí chemici Carl Paal a Ludwig Knorr nejprve jako způsob přípravy furanů, který byl posléze upraven pro tvorbu pyrrolů a thiofenů.[1][2]
Přestože byla Paalova–Knorrova syntéza široce využívaná, tak její mechanismus byl plně objasněn až v 90. letech 20. století.[3][4]
Přípravy furanů touto metodou vyžadují kyselé katalyzátory:[5]

Při přípravách pyrrolů se používají primární aminy:

a u syntéz thiofenů sulfid fosforečný:

Mechanismy
Příprava furanů
Příprava furanů je katalyzována kyselinou a začíná protonací jednoho z karbonylů, po čemž vzniklý enol reaguje s druhým karbonylem. Následně vznikne dehydratací poloacetalu furan.[6]

Tento mechanismus byl nalezen v roce 1995.[3] Bylo přitom zjištěno, že odlišné diastereomery 3,4-disubstituovaných hexan-2,5-dionů reagují různě rychle; podle obecného mechanismu by měly vytvářet stejný enolový meziprodukt, a meso- a d,l-racemické meziprodukty by se tak měly cyklizovat stejně rychle. Příčinou rozdílů je soustředěný průběh tvorby enolu a cyklizace – z tohoto důvodu byl navržen mechanismus zahrnující reakci protonovaného karbonylu se vznikajícím enolem. Nezreagované diony nepodléhají konformačním izomerizacím, což také vylučuje enolový meziprodukt.
Příprava pyrrolů
Mechanismus tvorby pyrrolů byl popsán roku 1991.[4] Protonovaný karbonyl je atakován aminem a vytváří se poloaminal. Reakcí aminu s dalším karbonylem se vytvoří derivát 2,5-dihydroxypyrrolidinu, který se dehydratuje na substituovaný pyrrol.[7]

Reakce zpravidla probíhá za přítomnosti protických nebo Lewisových kyselin, používají se obvykle primární aminy. Produkty bez substituce na dusíku lze získat z amoniaku nebo octanu amonného.
Příprava thiofenů
Paalova-Knorrova příprava thiofenů proíhá podobně jako v případě furanů. Původní diketon se na thioketon převádí sulfurizačním činidlem, poté reakce probíhá analogicky k přípravě furanů.[8]

Většina sulfurizačních činidel má silné dehydratační účinky, čímž reakci usnadňují. První návrhy mechanismu naznačovaly, že thiofeny vznikají sulfurizacemi produktů příprav furanů, ale zkoumání izolovaných furanů připravovaných za přítomnosti sulfidu fosforečného bylo v rozporu s obdobnými reakcemi 1,4-dikarbonylových sloučenin, čímž byla sulfurizace furanů vyloučena a podpořena sulfurizace dikarbonylů za vzniku thioketonů.[8]
Rozsah

Paalovy–Knorrovy syntézy mají široký rozsah využití, téměř všechny dikarbonylové sloučeniny lze jejich prostřednictvím přeměnit na heterocykly. R2 a R5 může být H, aryl, nebo alkyl. R3 a R4 mohou být H, aryl, alkyl, nebo esterová skupina. V přípravách pyrrolů (X = N) může R1 být H, aryl, alkyl, amin, nebo hydroxyl.[9]
Reakce mohou probíhat za rozličných, většinou mírných, podmínek. Furany se obvykle připravují ve vodných roztocích protických kyselin, například sírové nebo chlorovodíkové, případně v bezvodých prostředích s Lewisovými kyselinami nebo dehydratačními činidly, jako například oxidem fosforečným, anhydridy karboxylových kyselin, nebo chloridem zinečnatým. The Příprava pyrrolů vyžaduje primární aminnebo amoniak či jeho prekurzory, přičemž se provádí za obdobných podmínek. Syntézy thiofenů se uskutečňují pomocí sulfurizačních činidel, nejčastěji sulfidu fosforečného, Lawessonova činidla, nebo sulfanu.
Původní Paalovy–Knorrovy syntézy měly nevýhodu v podobě omezené dostupnosti 1,4-diketonů, což zlepšily nové chemické postupy; možnosti Paalových-Knorrových syntéz také rozšířily jejich obměny. Omezení také představují reakční podmínky, například delší zahřívání v kyselině, které může rozkládat citlivé funkční skupiny na furanech. Novější postupy využívají mírnější podmínky, kdy není potřeba zahřívání, jako jsou mikrovlnně katalyzované cyklizace.
Obměny
1,4-dikarbonylové sloučeniny lze nahradit jinými, které mají odlišnou strukturu, ale reagují podobnými mechanismy.
β,γ-epoxykarbonyly
β,γ-epoxykarbonylové sloučeniny se mohou cyklizovat na furany; získávají se z β-nenasycených karbonylů, které se dají epoxidovat. Vzniklé epoxykarbonylové sloučeniny se v kyselých nebo zásaditých prostředích cyklizují na furany.[10]

2-yn-1,4-dioly
Také 2-yn-1,4-dioly se účastní Paalových–Knorrových reakcí. Za katalýzy palladiem se 2-yn-1,4-dioly izomerizují na odpovídající 1,4-diketony a následně působením dehydratačních činidel vytvářejí furany.[11]

Tato varianta rozšiřuje možnosti Paalovy–Knorrovy syntézy využitím již známých reakcí alkynů, jako je tvorba propargylalkoholů.
Acetaly
Také acetaly je možné použít pro Paalovy-Knorrovy syntézy. Keton s acetalovou skupinou vzdálenou o 3 vazby lze na odpovídající heterocyklus přeměnit za stejných podmínek jako 1,4-diketon.
Mikrovlnná varianta
Při Paalových–Knorrových syntézách lze použít mikrovlnné záření. Původní Paalovy–Knorrovy podmínky zahrnují zahřívání silných kyselin po několik hodin, aby došlo k účinné dehydrataci. Mikrovlnné obměny trvají řádově minuty, v otevřených baňkách, a za pokojové teploty.[12]
Podobné reakce
Knorrova syntéza pyrrolů, popsaná roku 1884, je příprava substituovaných pyrrolů z aminoketonů a ketonů.[13]
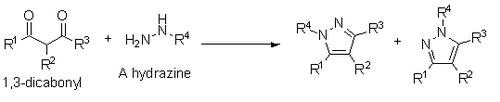
Popsána je také příprava pyrazolů z 1,3-dikarbonylových sloučenin a hydrazinů, hydrazidů, nebo semibikarbazidů. Probíhá podobným kondenzačním mechanismem jako Paalova-Knorrova syntéza, ale při použití substituovaných hydrazinů vede ke směsi regioizomerů, ve kterých je substituovaný heteroatom vedle substituentu R1 nebo R3.[14]
Syntetická využití
V roce 2000 provedli Barry Trost et al. syntézu antibiotika roseofilinu. Makrocyklické jádro bylo vytvořeno s využitím Paalovy–Knorrovy syntézy při tvorbě kondenzovaného pyrrolového kruhu.[15] 1,4-diketon byl zahříván v methanolu s octanem amonným, kyselinou kamforsulfonovou, a 0,4nm molekulárním sítem za vzniku pyrrolu bez N-substituce. Tento pyrrol se ukázal být nestálým, a tak byl před izolací stabilizován 2-(trimethylsilyl)ethoxymethylchloridem.

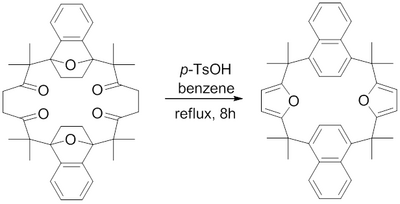
V roce 1982 byla popsána tvorba makrocyklu obsahujícího kondenzované furanové skupiny Paalovou–Knorrovou syntézou. 1,4-keton se dehydratoval refluxovanou kyselinou p-toluensulfonovou v benzenu.[16]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Paal–Knorr synthesis na anglické Wikipedii.
- ↑ C. Paal. Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters. Berichte der deutschen chemischen Gesellschaft. 1884, s. 2756–2767. Dostupné online. doi:10.1002/cber.188401702228.
- ↑ L. Knorr. Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester. Berichte der deutschen chemischen Gesellschaft. 1884, s. 2863–2870. Dostupné online. doi:10.1002/cber.188401702254.
- ↑ a b V. Amarnath; K. Amarnath. Intermediates in the Paal-Knorr Synthesis of Furans. The Journal of Organic Chemistry. 1995, s. 301–307. doi:10.1021/jo00107a006.
- ↑ a b V. Amarnath; D. C. Anthony; K. Amarnath; W. M. Valentine; L. A. Wetterau; D. G. Graham. Intermediates in the Paal-Knorr synthesis of pyrroles. The Journal of Organic Chemistry. 1991, s. 6924–6931. doi:10.1021/jo00024a040.
- ↑ Thomas L. Gilchrist. Heterocyclic Chemistry. [s.l.]: Longman Scientific, 1987. ISBN 0-582-01421-2.
- ↑ László Kürti; Barbara Czakó. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: [s.n.], 2005. ISBN 9780123694836.
- ↑ Adalbert Wollrab. Organische Chemie. [s.l.]: Springer, 1999. ISBN 3-540-43998-6. S. 850.
- ↑ a b E. Campaigne; W. O. Foye. The Synthesis of 2,5-Diarylthiophenes. The Journal of Organic Chemistry. 1952, s. 1405–1412. doi:10.1021/jo50010a023.
- ↑ R. W. Holman. Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms (Kürti, László; Czakó, Barbara). Journal of Chemical Education. 2005, s. 1780. doi:10.1021/ed082p1780.3. Bibcode 2005JChEd..82S1780H.
- ↑ R. A. Cormier; M. D. Francis. The Epoxyketone-Furan Rearrangement. Synthetic Communications. 1981, s. 365. doi:10.1080/00397918108064300.
- ↑ J. Ji; X. Lu. Facile synthesis of 2,5-disubstituted furans via palladium complex and perfluorinated resinsulfonic acid catalysed isomerization–dehydration of alkynediols. Journal of the Chemical Society, Chemical Communications. 1993, s. 764-765. doi:10.1039/C39930000764.
- ↑ G. Minetto; L. F. Raveglia; M. Taddei. Microwave-Assisted Paal−Knorr Reaction. A Rapid Approach to Substituted Pyrroles and Furans. Organic Letters. 2004, s. 389-392. doi:10.1021/ol0362820. PMID 14748600.
- ↑ L. Knorr. Synthese von Pyrrolderivaten. Berichte der deutschen chemischen Gesellschaft. 1884, s. 1635-1642. Dostupné online. doi:10.1002/cber.18840170220.
- ↑ L. Knorr. Einwirkung von Acetessigester auf Phenylhydrazin. Berichte der deutschen chemischen Gesellschaft. 1883, s. 2597-2599. Dostupné online. doi:10.1002/cber.188301602194.
- ↑ B. M. Trost; G. A. Doherty. An Asymmetric Synthesis of the Tricyclic Core and a Formal Total Synthesis of Roseophilin via an Enyne Metathesis. Journal of the American Chemical Society. 2000, s. 3801-3810. doi:10.1021/ja9941781.
- ↑ H. Hart; Y. Takehira. Adducts derived from furan macrocycles and benzyne. The Journal of Organic Chemistry. 1982, s. 4370-4372. doi:10.1021/jo00143a049.
Související články
- Hantzschova syntéza pyrrolů
- Knorrova syntéza pyrrolů
- Feistova–Benaryova syntéza
- Volhardova–Erdmannova cyklizace
- Hantzschova syntéza pyridinů

