Knorrova syntéza pyrrolů
Knorrova syntéza pyrrolů je chemická reakce sloužící k přípravě substituovaných pyrrolů.[1][2][3]
Spočívá v reakci α-aminovaného ketonu se sloučeninou obsahující skupinu odtahující elektrony (například esterem, jak je zobrazeno níže) v poloze α vůči karbonylové skupině.[4]

Provedení
Reakce se katalyzuje zinkem a kyselinou octovou a probíhá za pokojové teploty. Protože α-aminoketony snadno podléhají autokondenzacím, tak se musí připravovat během procesu; nejčastěji se získávají z odpovídajících oximů Neberovým přesmykem.[5][6]
Při původní Knorrově syntéze byly použity dva ekvivalenty ethylacetacetátu, kde se jeden rozpuštěním v koncentrované kyselině octové přeměňoval na ethyl 2-oximinoacetaceát, a poté byl pomalu přidáván jeden ekvivalent nasyceného vodného roztoku dusitanu sodného, za průběžného chlazení. Následně byl přimíchán práškový zinek, což vedlo k redukci oximu na amin; tato redukce spotřebovala dva ekvivalenty zinku a čtyři ekvivalenty kyseliny octové. Takto vzniklý produkt, diethyl-3,5-dimethylpyrrol-2,4-dikarboxylát, bývá označován jako Knorrův pyrol.
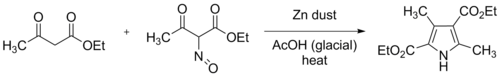
Při moderních syntézách se postupně přidává práškový zinek a roztok oximu vzniklý nitrosací do důkladně promíchávaného roztoku ethylacetacetátu v kyselině octové. Reakce je exotermní a a směs se bez vnějšího chlazení může zahřát na teplotu varu.
Knorrův pyrrol lze upravovat řadou postupů. Jeden ekvivalent hydroxidu vyvolá selektivní zmýdelnění 2-esteru. Při rozpuštění Knorrova pyrrolu v koncentrované kyselině sírové a nalití vzniklého roztoku do vody dochází k selektivní hydrolýze 4-esterové skupiny. 5-methyl lze stechiometrickým množstvím chloridu sulfurylu v koncentrované kyselině octové zoxidovat na chlormethyl, aldehyd, nebo karboxyl.[7] Také lze alkylovat atom dusíku. Obě esterové skupiny lze od sebe rozlišit zavedením benzylových či terc-butylových substituentů prostřednictvím příslušných acetacetátových esterů. Benzylové skupiny je možné oddělit katalytickou hydrogenolýzou za katalýzy palladiem na uhlíku a terc-butyly pomocí kyseliny trifluoroctové nebo vroucí kyseliny octové.
R1 a R3 (a také R2 a Et) mohou reagovat s acylchloridy, Meldrumovou kyselinou, nebo alkoholy, za vzniku β-ketoesterů; tímto postupem se snadno vytvářejí ethyl- a benzylestery a i silně stíněné alkoholy, například terc-butanol, dávají vysoké výtěžky.[8]
V roce 1894 byl Knorrovou syntézou z acetylacetonu (pentan-2,4-dionu) a ethyl-2-oximinoacetacetátu získán ethyl 4-acetyl-3,5-dimethylpyrrol-2-karboxylát.[9]
4-acetyl lze Wolffovou–Kižněrovou redukcí, hydrogenolýtou, nebo pomocí diboranu, převést na 4-ethyl. Reakce se může účastnit také benzyl- nebo terc-butylacetacetát, kde se při pečlivém řízení teploty může výtěžnost dostat téměř na 80 %. [10]
N,N-dialkylpyrrol-2- a 4-karboxamidy lze připravit s využitím N,N-dialkylacetacetamidů. Variantami Knorrovy syntézy se dají vytvořit také thioestery.[11]
Nitrosace β-ketoesterů se i při pečlivém hlídání teploty chovají téměř jako titrace, směs se může zahřát i na 40 °C bez výrazného vlivu na konečný výtěžek.
Mechanismus
Mechanismus Knorrovy syntézy pyrrolů začíná kondenzací aminu s ketonem za vzniku iminu. Imin se poté tautomerizuje na enamin, následuje cyklizace, odštěpení vody, a izomerizace na pyrrol.

Podobné reakce
Řada významných syntéz pyrrolů se podobá Knorrově syntéze, ale mají odlišné mechanismy.
Hans Fischer a Emmy Fink zjistili, že při Zanettiho reakci pentan-2,4-dionu s ethyl-2-oximinoacetacetátem se jako vedlejší produkt vytváří ethyl-3,5-dimethylpyrrol-2-karboxylát a podobně se při použití 3-ketobutyraldehyddiethylacetalu tvoří ethyl-5-methylpyrrol-2-karboxylát; oba tyto vedlejší produkty jsou následky odštěpení acetylových skupin z ethyl-2-aminoacetacetátového meziproduktu. Významným produktem Fischerovy-Finkovy syntézy byl ethyl-4,5-dimethylpyrrol-2-karboxylát, vzniklý z ethyl-2-oximinoacetacetátu a 2-methyl-3-oxobutanalu.[12] George Kleinspehn ukázal, že lze dosáhnout toho, aby reakce probíhala výhradně tímto způsobem, když se použije, společně s pentan-2,4-dionem, diethyloximinomalonát nebo některý jeho 3-alkylovaný derivát. Výtěžky mohou být okolo 60 %.[13] Zlepšení výtěžků byl dosaženo použitím diethylaminomalonátu (předem připraveného hydrogenolýzou diethyloximinomalonátu v ethanolu za přítomnosti Pd/C) a přidáním směsi diethylaminomalonátu s β-diketonem ke vroucí kyselině octové.[14]
Fischerova-Finkova syntéza byla rozšířena o reakce 2-oximinoacetacetátových esterů (ethyl, benzyl, a terc-butyl) s 3-alkylovanými pentan-2,4-diony.[15] Kleinspehnovu syntézu se podařilo doplnit o asymetrické β-diketony, které přednostně reagují na méně stíněných acetylových skupinách a vytváří příslušné 5-methylpyrrol-2-karboxylátové estery. N,N-dialkyl 2-oximinoacetacetamidy mohou vytvářet pyrroly reakcemi s 3-substituovanými pentan-2,4-diony, přičemž výtěžnosti bývají podobné jako u odpovídajících esterů (okolo 45 %); při použití asymetriclých diketonů acylové skupiny z acetacetamidu zůstávají v molekulách produktů a jeden z diketonových acylů se ztrácí.[16]
Podobné okolnosti mechanismu se v menší míře objevují také u reakcí acetacetátových esterů, potvrzeny byly radiochemicky.[17]
Knorrovy syntézy a jejich obměny mají využití při přípravách porfyrinů, žlučových barviv, a dipyrrinů.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Knorr pyrrole synthesis na anglické Wikipedii.
- ↑ Ludwig Knorr. Synthese von Pyrrolderivaten. Berichte der deutschen chemischen Gesellschaft. 1884, s. 1635-1642. Dostupné online. doi:10.1002/cber.18840170220.
- ↑ Ludwig Knorr. Synthetische Versuche mit dem Acetessigester. Annalen der Chemie. 1886, s. 290-332. Dostupné online. doi:10.1002/jlac.18862360303.
- ↑ Ludwig Knorr; H. Lange. Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen. Berichte der deutschen chemischen Gesellschaft. 1886, s. 2998-3008. Dostupné online. doi:10.1002/cber.19020350392.
- ↑ Alsoph Henry Corwin. Heterocyclic Compounds. New York: John Wiley & Sons, 1950. Dostupné online. doi:10.1002/cber.19020350392. Kapitola The Chemistry of Pyrrole and its Derivatives, s. 287 ff.
- ↑ FISCHER, Hans. 2,4-Dimethyl-3,5-dicarbethoxypyrrole (2,4-Pyrroledicarboxylic acid, 3,5-dimethyl-, diethyl ester). Org. Synth.. 1935, s. 17. Dostupné online. doi:10.15227/orgsyn.015.0017.; Coll. Vol.. S. 202.
- ↑ FISCHER, Hans. Kryptopyrrole (Pyrrole, 2,4-dimethyl-3-ethyl). Org. Synth.. 1941, s. 67. Dostupné online. doi:10.15227/orgsyn.021.0067.; Coll. Vol.. S. 513.
- ↑ Alsoph H. Corwin; William A. Bailey; Paul Viohl. Structural Investigations upon a Substituted Dipyrrylmethane. An Unusual Melting Point-Symmetry Relationship. Journal of the American Chemical Society. 1942, s. 1267-1273. doi:10.1021/ja01258a007.
- ↑ Yuji Oikawa; Kiyoshi Sugano; Osamu Yonemitsu. Meldrum's acid in organic synthesis. 2. A general and versatile synthesis of β-keto esters. The Journal of Organic Chemistry. 1978, s. 2087-2088. doi:10.1021/jo00404a066.
- ↑ C. U. Zanetti; E. Levi. Sintesi di composti pirrolici dai nitrosochetoni. La Gazzetta Chimica Italiana. 1894, s. 546-554. Dostupné online.
- ↑ Alfred E. Treibs; Karl Hintermeier. tert-Butylester von Pyrrolcarbonsäuren. Chemische Berichte. 1954, s. 1167-1174. doi:10.1002/cber.19540870818.
- ↑ E. Bullock; T. S. Chen; C. E. Loader. Preparation and reactions of some pyrrylthiol esters. Canadian Journal of Chemistry. 1966, s. 1007-1111. doi:10.1139/v66-149.
- ↑ Hans Fischer; Emmy Fink. Über eine neue Pyrrolsynthese. Zeitschrift für Physiologische Chemie. 1948, s. 152-161. doi:10.1515/bchm2.1948.283.3-4.152.
- ↑ George G. Kleinspehn. A Novel Route to Certain 2-Pyrrolecarboxylic Esters and Nitriles. Journal of the American Chemical Society. 1955, s. 1546-1548. doi:10.1021/ja01611a043.
- ↑ John B. Paine; David Dolphin. Pyrrole chemistry. An improved synthesis of ethyl pyrrole-2-carboxylate esters from diethyl aminomalonate. The Journal of Organic Chemistry. 1985, s. 5598-5604. doi:10.1021/jo00350a033.
- ↑ E. Bullock; A. W. Johnson; E. Markham; K. B. Shaw. 287. A synthesis of coproporphyrin III. Journal of the Chemical Society (Resumed). 1958, s. 1430-1440. doi:10.1039/JR9580001430.
- ↑ John B. Paine; Jonathan R. Brough; Kathy K. Buller; Erika E. Erikson; D. Dolphin. Mechanism of the formation of N,N-dialkyl-2-pyrrolecarboxamides from 1,3-diketones and N,N-dialkyloximinoacetoacetamides. The Journal of Organic Chemistry. 1987, s. 3993-3997. doi:10.1021/jo00227a010.
- ↑ Henry Rapoport; John W. Harbuct. Mechanism of a modified Knorr pyrrole condensation. The Journal of Organic Chemistry. 1971, s. 853-855. doi:10.1021/jo00805a030.
Související články
- Hantzschova syntéza pyrrolů
- Paalova–Knorrova syntéza

