Hantzschova syntéza pyrrolů
Hantzschova syntéza pyrrolů je reakce β-ketoesteru (1) s amoniakem nebo primárním aminem a α-haloketonem (2) za vzniku substituovaného pyrrolu (3); objevil ji Arthur Rudolf Hantzsch.[1][2] Pyrrolové skupiny jsou součástmi mnoha biologicky účinných molekul, přípravy substituovaných pyrrolů tak mají velký význam v lékařské chemii.[3][4]
Jsou popsané i jiné způsoby přípravy pyrrolů, například Knorrova syntéza pyrrolů a Paalova-Knorrova syntéza.
Mechanismus
Níže je zobrazen pravděpodobný mechanismus této reakce:[5]

Mechanismus začíná reakcí aminu (1) s β-uhlíkem β-ketoesteru (2), jež dá vzniknout enaminu (3). Enamin poté atakuje karbonylový uhlík α-haloketonu (4). Následuje odštěpení H2O, vedoucí k tvorbě iminu (5). U tohoto meziproduktu nastane vnitromolekulární nukleofilní atak, vytvářející pětičlenný kruh (6). Nakonec se oddělí vodík a vazby pí na kruhu se přeskupí za vzniku konečného produktu (7).
Jiný navržený mechanismus zahrnuje atak enaminu (3) na α-uhlíku α-haloketonu (4), jako součást nukleofilní substituce namísto reakce s karbonylovým uhlíkem.[6]
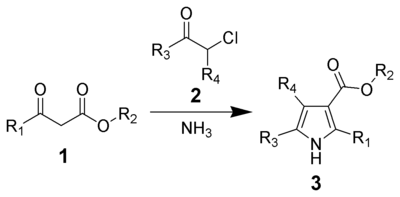
Zobecněná reakce
Vysoce substituované pyrroly lze připravit v jedné nádobě z ketonů, N-jodsukcinimidu, a kyseliny p-toluensulfonsulfonové za vzniku α-jodketonu,[7] ke kterému se poté přidají primární amin, β-dikarbonylová sloučenina, dusičnan amonno-ceričitý, a dusičnan stříbrný:

Použití
2,3-dikarbonylované pyrroly
Hantzschovou syntézou lze také získat 2,3-dikarbonylované pyrroly.[8] Tyto pyrroly jsou vhodné pro totální syntézy, jelikož se karbonylové skupiny dají přeměnit na řadu dalších.

Substituované indoly
Reakcemi enaminů s α-haloketony lze také připravovat substituované indoly.[6][9]

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Hantzsch pyrrole synthesis na anglické Wikipedii.
- ↑ Hantzsch, A. Chemische Berichte 1890, 23, 1474
- ↑ Feist, F. Chemische Berichte 1902, 35, 1538
- ↑ Furstner, A. Angewandte Chemie International Edition 2003, 42¸ 3582-3603
- ↑ Marco Leonardi; Verónica Estévez; Mercedes Villacampa; J. Menéndez. The Hantzsch Pyrrole Synthesis: Non-conventional Variations and Applications of a Neglected Classical Reaction. Synthesis. 2019, s. 816–828. Dostupné online. ISSN 0039-7881. doi:10.1055/s-0037-1610320.
- ↑ Li, J.J. Name Reactions; 4th ed.; Springer-Verlag: Berlin, Germany, 2009; p. 276
- ↑ a b Wang, Zerong. Comprehensive Organic Name Reactions and Reagents, 3 Volume Set; John Wiley & Sons, Hoboken, New Jersey, 2009; pp. 1326-1327
- ↑ Estevez, V.; Villacampa, M.; Menendez, J.C. Chemical Communications 2012, 49, 591-593
- ↑ Moss, T.A.; Nowak, T. Tetrahedron Letters 2012, 53, 3056-3060
- ↑ Jones, C.D; Suarez, T. Journal of Organic Chemistry 1972, 37, 3622-3623

