Karvon
| Karvon | |
|---|---|
 Strukturní vzorec (R)- a (S)-karvonu
| |
 Model molekuly (R)-karvonu
| |
 Model molekuly (S)-karvonu
| |
| Obecné | |
| Systematický název | 2-methyl-5-(prop-1-en-2-yl)cyklohex-2-en-1-on |
| Sumární vzorec | C10H14O |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 99-49-0 |
| EC-no (EINECS/ELINCS/NLP) | 202-759-5 |
| PubChem | 7439 |
| ChEBI | 38265 |
| SMILES | CC1=CCC(CC1=O)C(=C)C |
| InChI | InChI=1S/C10H14O/c1-7(2)9-5-4-8(3)10(11)6-9/h4,9H,1,5-6H2,2-3H3 |
| Vlastnosti | |
| Molární hmotnost | 150,22 g/mol |
| Teplota tání | 25,2 °C (298,4 K) (R-izomer) <15 °C (<288 K) (S-izomer)[1] |
| Teplota varu | 230-231 °C (503-504 K)[1] |
| Hustota | 0,96 g/cm3 |
| Index lomu | 1,500[1] (20 °C)[1] |
| Rozpustnost ve vodě | 0,13 g/100 ml (R-izomer)[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v ethanolu, chloroformu, a propylenglykolu, nerozpustný v glycerolu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru[1] |
| Tlak páry | 0,02 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H317[1] |
| P-věty | P261 P264 P270 P272 P280 P301+317 P302+352 P321 P330 P333+317 P362+364 P501[1] |
|
Některá data mohou pocházet z datové položky.
| |
Karvon je organická sloučenina, patřící mezi terpenoidy.[2]
Karvon je složkou řasy silic, nejvíce jej obsahují kmín kořenný (Carum carvi), máta klasnatá (Mentha spicata), a kopr.[3]
Použití
V potravinářství
Oba izomery karvonu mají využití v potravinářství;[3] pro tyto účely se obvykle vyrábí z limonenu. Silice obsahující karvony mají, podobně jako další silice, využití v aromaterapii.
V zemědělství
S-(+)-karvon se používá k tlumení předčasného klíčení skladovaných brambor.[3]
Stereoizomerie a pach
Karvon vytváří dva enantiomery: R-(−)-karvon, s nasládlou mátovou vůní, a S-(+)-karvon, jehož vůně se podobá žitu.[4][5]
Vůni obou enantiomerů karvonu jsou schopné rozlišit také opice z rodu kotul.[6]
Výskyt
S-(+)-karvon je hlavní složkou (60–70 %) oleje ze semen kmínu kořenného,[7] také tvoří 40-60 % oleje z koprových semen a vyskytuje se i ve slupkách mandarinek. R-(−)-karvon je významnou složkou oleje z několika mát, například máty klasnaté,[8] která je hlavním přírodním zdrojem R-(−)-karvonu; většina R-(−)-karvonu se ale vyrábí uměle z R-(+)-limonenu.[9]
Historie
Kmín kořenný se v lékařství používal již ve starověkém Římě;[3] samotný karvon jako čistou látku ale izoloval až Franz Varrentrapp v roce 1849.[2][10] látka byla původně nazývána karvol. Heinrich Goldschmidt a Robert Zürrer zjistili roku 1885, že se jedná o keton podobný limonenu,[11] a přesnou strukturu zjistil roku 1894 Georg Wagner.[12]
Vznik
Karvon lze získat z přírodních zdrojů, kde se ale nevyskytuje v dostatečných množstvích, většinou se tak získává přeměnou limonenu.
Pravotočivá forma, S-(+)-karvon, se vyrábí v čisté podobě frakční destilací oleje z kmínu kořenného; u extrakce R-(−)-karvonu je obvykle třeba k destilaci přidat další postupy., například tvorbu aduktu se sulfanem, ze kterého se karvon oddělí hydroxidem draselným a destilací s vodní parou.
Při výrobě z limonenu nejprve limonen reaguje s chloridem nitrosylu, kdy při zahřívání vzniká karvoxim, který se působením kyseliny šťavelové mění na karvon;[13] z R-(+)-limonenu se přitom tvoří R-(−)-karvon.
Hlavním využitím D-limonenu je výroba S-(+)-karvonu.[14]
Biosyntéza karvonu probíhá skrz oxidaci limonenu.
Chemické vlastnosti
Redukce
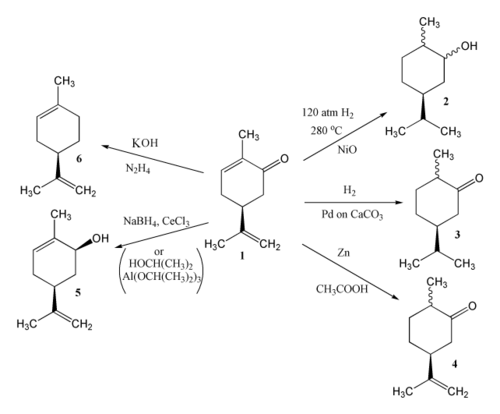
Dvojnou vazbu karvonu je možné redukovat, přičemž produkt závisí na použitých činidlech a na reakčních podmínkách.[2] Katalytickou hydrogenací karvonu (1) lze získat karvomenthol (2) nebo karvomenthon (3). Se zinkem a kyselinou octovou se vytváří dihydrokarvon (4). Meerweinovou–Ponndorfovou–Verleyovou redukcí využívající propan-2-ol a isopropoxid hlinitý se redukuje karbonylová skupina a vzniká karveol (5); lze také využít Lucheovu redukci, kdy se redukční činidlo vytváří ze směsi tetrahydridoboritanu sodného a chloridu ceritého. S hydrazinem a hydroxidem draselným vznikne Wolffovou–Kižněrovou redukcí limonen (6).
Oxidace
Oxidace karvonu také mohou mít různé produkty.[2] Za přítomnosti zásady, jako je například hydroxid barnatý, se karvon oxiduje vzdušným kyslíkem na diketon 7. S peroxidem vodíku vytváří epoxid 8. Reakcí s ozonem se vytváří dilakton 9, manganistan draselný jej oxiduje na sloučeninu 10.

Konjugované adice
Podobně jako další α,β;-nenasycené ketony může karvon vstupovat do nukleofilních konjugovaných adicí; s Gilmanovými činidly reaguje za navázání alkylových skupin do polohy trans vůči isopropenylu. Vzniklý enolát může být následně allylován allylbromidem na keton 11.[15]

Ostatní
Jelikož je snadno dostupný v enantiomerně čistých podobách, tak se karvon často používá jako výchozí látka asymetrické totálních syntéz; například (S)-(+)-karvon byl v roce 1998 použit jako výchozí látka pro přípravu terpenoidu kvasinu:[16]

V roce 1908 bylo popsáno, jak se karvon po vystavení slunečnímu světlu po dobu jednoho roku přeměnil enon–alkenovou cykloadicí na karvon-kafr.[17]
Metabolismus
Oba enantiomery karvonu se převážně metabolizují na kyselinu dihydrokarvonovou, kyselinu karvonovou, a uroterpenolon.[18]
Redukcí za přítomnosti NADPH vzniká, jako menšinový produkt, zR-(−)-karvonu také (–)-karveol a z (+)-karvonu (+)-karveol;[19] tento děj probíhá hlavně v játrech a účastní se jej cytochrom P450 oxiáza a (+)-trans-karveol dehydrogenáza.
Reference
V tomto článku byl použit překlad textu z článku Carvone na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/7439
- ↑ a b c d J. L. Simonsen. The Terpenes. Cambridge: Cambridge University Press, 1953. S. 394–408.
- ↑ a b c d C. C. C. R. De Carvalho; M. M. R.Da Fonseca. Carvone: Why and how should one bother to produce this terpene. Food Chemistry. 2006, s. 413–422. doi:10.1016/j.foodchem.2005.01.003.
- ↑ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi. Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones. Journal of Agricultural and Food Chemistry. 1971, s. 785–787. doi:10.1021/jf60176a035.
- ↑ Caterina Morcia; Giorgio Tumino; Roberta Ghizzoni; Valeria Terzi. Carvone (Mentha spicata L.) Oils - Essential Oils in Food Preservation, Flavor and Safety - Chapter 35. Essential Oils in Food Preservation, Flavor and Safety. 2016, s. 309–316. doi:10.1016/B978-0-12-416641-7.00035-3.
- ↑ M. Laska; A. Liesen; P. Teubner. Enantioselectivity of odor perception in squirrel monkeys and humans. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 1999, s. R1098–R1103. doi:10.1152/ajpregu.1999.277.4.r1098. PMID 10516250.
- ↑ Hornok, L. Cultivation and Processing of Medicinal Plants, John Wiley & Sons, Chichester, UK, 1992
- ↑ [1] Archivováno 10. 4. 2012 na Wayback Machine., Chemical composition of essential oil from several species of mint (Mentha spp.)
- ↑ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2003. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a11_141. Kapitola Flavors and Fragrances.
- ↑ Handwörterbuch der reinen und angewandten Chemie, Friedrich Vieweg und Sohn, 1849
- ↑ Heinrich Goldschmidt and Robert Zürrer (1885) "Ueber das Carvoxim," Berichte der Deutschen Chemischen Gesellschaft, 18 : 1729–1733
- ↑ Georg Wagner (1894) "Zur Oxydation cyklischer Verbindungen", Berichte der Deutschen chemischen Gesellschaft zu Berlin, vol. 27, pages 2270-2276
- ↑ Otis S. Rothenberger; Stuart B. Krasnoff; Ronald B. Rollins. Conversion of (+)-Limonene to (−)-Carvone: An organic laboratory sequence of local interest. Journal of Chemical Education. 1980, s. 741. doi:10.1021/ed057p741. Bibcode 1980JChEd..57..741R.
- ↑ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg "Flavors and Fragrances", Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim doi:10.1002/14356007.a11_141
- ↑ A. Srikrishna; T. Jagadeeswar Reddy. Enantiospecific synthesis of (+)-(1S, 2R, 6S)-1, 2-dimethylbicyclo [4.3. 0] nonan-8-one and (−)-7-epibakkenolide-A.Chybí název periodika! 1998, s. 11517–11524. doi:10.1016/S0040-4020(98)00672-3.
- ↑ (a) Shing, T. K. M.; Jiang, Q; Mak, T. C. W. Journal of Organic Chemistry 1998, 63, 2056-2057 (b) Shing, T. K. M.; Tang, Y. Journal of the Chemical Society, Perkin Transactions 1 1994, 1625
- ↑ G. Ciamician; P. Silber. Chemische Lichtwirkungen. Chemische Berichte. 1908, s. 1928. Dostupné online. doi:10.1002/cber.19080410272.
- ↑ W. Engel. In vivo studies on the metabolism of the monoterpenes S-(+)- and R-(−)-carvone in humans using the metabolism of ingestion-correlated amounts (MICA) approach. Journal of Agricultural and Food Chemistry. 2001, s. 4069-4075. doi:10.1021/jf010157q. PMID 11513712.
- ↑ W. Jager; M. Mayer; P. Platzer; G. Reznicek; H. Dietrich; G. Buchbauer. Stereoselective metabolism of the monoterpene carvone by rat and human liver microsomes. Journal of Pharmacy and Pharmacology. 2000, s. 191-197. doi:10.1211/0022357001773841. PMID 10714949.


