Enon–alkenová cykloadice
Enon–alkenová cykloadice je [2+2] cykloadiční reakce využívající jako substráty α,β- enony a alkeny. Přestože Woodwardova–Hoffmannova pravidla umožňují fotochemickou [2+2] cykloadici, tak reakce enonů s alkeny probíhají postupným mechanismem za účasti diradikálových meziproduktů.[1]
Historie
V roce 1908 bylo popsáno, že se karvon po dobu jednoho roku vystavený slunečnímu svitu přeměnil na karvon-kafr.[2] Další výzkum vedl ke zjištění, že pro fotochemické [2+2] cykloadice enonů na alkeny je sluneční světlo dostačující.[3][4]
Mechanismus
Mechanismus reakce je postupný a radikálový. Začíná fotoexcitací enonu do singletového excitovaného stavu. Tento singletový stav obvykle přetrvává velmi krátkou dobu a přechází do tripletu. V tomto okamžiku enon vytvoří se základním stavem alkenu excimer, čímž vznikne tripletový diradikál. Inverze spinu na singletový diradikál umožní uzavření cyklobutanového kruhu.[5]
Navržen byl také pericyklický mechanismus, ve kterém vznikají radikálový kation a radikálový anion, jež se rekombinují za tvorby cyklobutanu.[6]

Rozsah a omezení
Enon–alkenové cykloadice mohou, v závislosti na orientaci substituentů na alkenu a na enonovém karbonylu, vytvářet dva různé izomery. Selektivita vůči jednomu z izomerů závisí na sterických i elektronových vlivech.

Na regiochemii produktů mají největší vliv sterické a elektrostatické interakce mezi alkenem a excitovaným enonem. Enony mají v excitovaných stavech obrácenou polaritu a na β-uhlíku se tak nachází částečný záporný náboj. V přechodném stavu odpovídajícímu vytváření první vazby má alken tendenci k takovému uspořádání, že je jeho záporný dipól orientován směrem od β uhlíku enonu.[7]

Sterické interakce vynucují navazování velkých substituentů na opačné strany vytvářeného cyklobutanového kruhu.[7]

Pokud se enonová a alkenová skupina nachází na kruhu tvořeném pěti nebo méně atomy, tak se konfigurace dvojné vazby zachovává, u větších kruhů ale může vedle cykloadice také docházet k izomerizaci, kdy se vytváří směsi cis- a trans-produktů.[8]

Diastereofaciální selektivitu lze většinou dobře předvídat; převážně reagují méně stíněné strany enonu a alkenu.[9]

Vnitromolekulární enon–alkenové cykloadice mohou vytvářet, v závislosti na regioselektivitě reakce, „ohnuté“ i „rovné“ produkty. Jestliže je enonová skupina od alkenové oddělena dvěma atomy, převažují ohnuté produkty, protože dochází k rychlé tvorbě pětičlenných kruhů.[10] Molekuly s většími rozmezími mezi těmito skupinami vytvářejí především rovné produkty.[11]

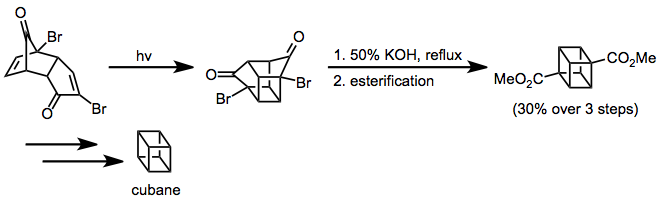
Enon–alkenovou cykloadici lze použít na přípravu kubanu;[12]Favorského přesmyk vytvoří uhlíkovou kostru kubanu a dalšími úpravami se získá nefunkcionalizovaný produkt.
Provedení
Enon–alkenové cykloadice jsou často doprovázeny vedlejšími reakcemi, obvykle souvisejícímis diradikálovými meziprodukty. Jejich vliv lze omezit úpravou reakčních podmínek.
Reaktanty a rozpouštědlo by neměly obsahovat rozpuštěný kyslík, který je fotoreaktivní.
Lze použít mnoho různých rozpouštědel; například aceton zvyšuje fotocitlivost tripletových stavů. Alkanová rozpouštědla nemají obsahovat příměsi alkenů.
Důležitá je také vlnová délka excitačního záření.
U mezimolekulárních cykloadicí může nadbytek alkenu bránit dimerizaci enonu.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Enone–alkene cycloadditions na anglické Wikipedii.
- ↑ M. T. Crimmins; T. L. Reinhold. Enone Olefin [2 + 2] Photochemical Cycloadditions. Organic Reactions. 2004, s. 297–588. ISBN 0471264180. doi:10.1002/0471264180.or044.02.
- ↑ G. Ciamician; P. Silber. Chemische Lichtwirkungen. Chemische Berichte. 1908, s. 1928. Dostupné online. doi:10.1002/cber.19080410272.
- ↑ G. M. Buchi; I. M. Goldman. Photochemical Reactions. VII. the Intramolecular Cyclization of Carvone to Carvonecamphor. Journal of the American Chemical Society. 1957, s. 4741. doi:10.1021/ja01574a042.
- ↑ R. C. Cookson; E. Crundwell; J. Hudac. Chemistry & Industry. 1958, s. 1003.
- ↑ R. O. Loutfy; P. DeMayo. Primary Bond Formation in the Addition of Cyclopentenone to Chloroethylenes. Canadian Journal of Chemistry. 1972, s. 3465. doi:10.1139/v72-560.
- ↑ N. Schmeling, K. Hunger, G. Engler, B. Breiten, P. Roelling, A. Mixa, C. Staudt, K. Kleinermanns. Photo-crosslinking of poly[ethene-stat-(methacrylic acid)] functionalised with maleimide side groups. Polymer International. 2009, s. 720. doi:10.1002/pi.2583.
- ↑ a b E. J. Corey; J. D. Bass; R. LeMahieu; R. B. Mitra. A Study of the Photochemical Reactions of 2-Cyclohexenones with Substituted Olefins. Journal of the American Chemical Society. 1964, s. 5570. doi:10.1021/ja01078a034.
- ↑ P. DeMayo; A. A. Nicholson; M. F. Tchir. Evidence for reversible intermediate formation in cyclopentenone cycloaddition. Canadian Journal of Chemistry. 1969, s. 711. doi:10.1139/v69-115.
- ↑ S. W. Baldwin; M. T. Crimmins. Total synthesis of (−)-sarracenin by photoannelation. Journal of the American Chemical Society. 1982, s. 1132. doi:10.1021/ja00368a054.
- ↑ Y. Tamura; Y. Kita; H. Ishibashi; M. Ikeda. Intramolecular photocycloaddition of 3-allyloxy- and 3-allylamino-cyclohex-2-enones: formation of oxa- and aza-bicyclo[2,1,1]hexanes. Journal of the Chemical Society D. 1971, s. 1167. doi:10.1039/C29710001167.
- ↑ R. M. Coates; P. D. Senter; W. R. Baker. Annelative ring expansion via intramolecular [2 + 2] photocycloaddition of .alpha.,.beta.-unsaturated .gamma.-lactones and reductive cleavage: synthesis of hydrocyclopentacyclooctene-5-carboxylates. The Journal of Organic Chemistry. 1982, s. 3597–3607. doi:10.1021/jo00140a001.
- ↑ P. E. Eaton; T. W. Cole. Cubane. Journal of the American Chemical Society. 1964, s. 3157–3158. doi:10.1021/ja01069a041.

