Oxalylchlorid
| Oxalylchlorid | |
|---|---|
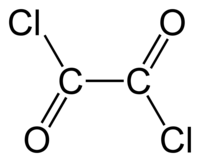 Strukturní vzorec
| |
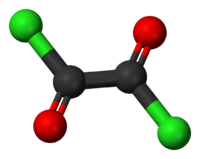 Kuličkový model molekuly
| |
 Kalotový model molekuly
| |
| Obecné | |
| Systematický název | Oxalyldichlorid |
| Ostatní názvy | Oxaloylchlorid, (di)chlorid kyseliny šťavelové |
| Sumární vzorec | C2O2Cl2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 79-37-8 |
| SMILES | ClC(=O)C(=O)Cl |
| Vlastnosti | |
| Molární hmotnost | 126,93 g/mol |
| Teplota tání | −16 °C (257 K) |
| Teplota varu | 63 až 64 °C (337 K) |
| Hustota | 1,4785 g/cm3 |
| Index lomu | 1,429 |
| Rozpustnost ve vodě | reaguje |
| Bezpečnost | |
|
[1] Nebezpečí[1] | |
| H-věty | H314 H331 |
| P-věty | P261 P280 P305 P310 P338 P351 |
|
Některá data mohou pocházet z datové položky.
| |
Oxalylchlorid (též oxaloylchlorid, systematický název oxalyldichlorid), je organická sloučenina, diacylchlorid kyseliny šťavelové. Používá se jako reaktant v organické syntéze[2]; lze jej připravit reakcí kyseliny šťavelové s chloridem fosforečným.
Oxalylchlorid poprvé připravil roku 1892 francouzský chemik Adrien Fauconnier reakcí diethyloxalátu s chloridem fosforečným.[3]
Reakce
Oxalylchlorid reaguje s vodou, přičemž vznikají pouze plynné produkty: chlorovodík (HCl), oxid uhličitý (CO2) a oxid uhelnatý (CO)
- (COCl)2 + H2O → 2 HCl + CO2 + CO
Touto vlastností se liší od ostatních acylchloridů, které se hydrolyzují na chlorovodík a původní karboxylové kyseliny.
Použití v organické syntéze
Oxidace alkoholů
Roztokem obsahujícím oxalylchlorid a dimethylsulfoxid (DMSO) se přeměňují alkoholy na odpovídající aldehydy a ketony procesem známým jako Swernova oxidace.
Syntéza acylchloridů
Oxalylchlorid se nejčastěji používá společně s N,N-dimethylformamidem (DMF) jako katalyzátorem v organické syntéze k přípravě acylchloridů. Podobně jako thionylchlorid se při této reakci mění na těkavé vedlejší produkty; jeden z menšinových vedlejších produktů je možný karcinogen.[4] Oproti thionylchloridu je mírnějším a selektivnějším reaktantem; je rovněž dražší a tak se většinou používá v menším měřítku.
Tato reakce zahrnuje přeměnu DMF na imidoylchloridový derivát (Me2N=CHCl+), podobně jako v prvním kroku Vilsmeierovy–Haackovy reakce. Imidoylchlorid je účinné chlorační činidlo.
Formylace arenů
Oxalylchlorid reaguje za přítomnosti chloridu hlinitého s aromatickými sloučeninami za vzniku odpovídajících acylchloridů v procesu známem jako Friedelova-Craftsova acylace. Vzniklý acylchlorid může být hydrolyzován na příslušnou karboxylovou kyselinu.
Příprava oxalátových diesterů
Podobně jako ostatní acylchloridy, i oxalylchlorid reaguje s alkoholy za vzniku esterů:
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Tyto reakce obvykle probíhají za přítomnosti zásady jako například pyridinu.
Ostatní
Oxalylchlorid byl údajně použit při první syntéze dioxantetraketonu (C4O6).
Odkazy
Související články
- Oxalyl
- Kyselina šťavelová
Externí odkazy
- Obrázky, zvuky či videa k tématu Oxalylchlorid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Oxalyl chloride na anglické Wikipedii.
- ↑ a b Oxalyl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Salmon, R. Encyclopedia of Reagents for Organic Synthesis. Oxalyl Chloride. New York: John Wiley & Sons, 2001. DOI 10.1002/047084289X.ro015.
- ↑ FAUCONNIER, Adrien. Action du perchlorure de phosphore sur l'oxalate d'éthyle. Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences de Paris. 1892, s. 122–123. Dostupné online. (French)
- ↑ CLAYDEN, Jonathan. Organic chemistry. Reprinted (with corrections). vyd. Oxford [u.a.]: Oxford Univ. Press, 2005. Dostupné online. ISBN 978-0-19-850346-0. S. 296.






