Dimer chloridu allylpalladnatého
| Dimer chloridu allylpalladnatého | |
|---|---|
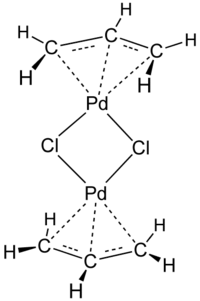 Strukturní vzorec
| |
 Model molekuly
| |
| Obecné | |
| Systematický název | dimer chloridu allylpalladnatého |
| Ostatní názvy | APC |
| Sumární vzorec | C6H10Cl2Pd2 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 12012-95-2 |
| EC-no (EINECS/ELINCS/NLP) | 234-579-8 |
| PubChem | 61538 |
| SMILES | Cl[Pd]CC=C.C=CC[Pd]Cl |
| InChI | InChI=1S/2C3H5.2ClH.2Pd/c2*1-3-2;;;;/h2*3H,1-2H2;2*1H;;/q;;;;2*+1/p-2 |
| Vlastnosti | |
| Molární hmotnost | 365,89 g/mol |
| Teplota rozkladu | 155 až 156 °C (428 až 429 K) |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu, methanolu a chloroformu |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
|
Některá data mohou pocházet z datové položky.
| |
Dimer chloridu allylpalladnatého (APC) je komplexní sloučenina se vzorcem [(η3-C3H5)PdCl]2. Používá se jako katalyzátor v organické syntéze.[2] Patří k nejpoužívanějším allylovým komplexům přechodných kovů.
Struktura
Tato sloučenina má dimerní centrosymetrickou strukturu. Každá allylová skupina leží v rovině, která tvoří se čtvercem vymezeným atomy palladia a uhlíku úhel 111,5°, délky všech vazeb Pd–C jsou stejné. Elementární buňka je monoklinická.[3]
Příprava
Tento komplex se připravuje reakcí oxidu uhelnatého s roztokem tetrachloropalladnatanu sodného (získaného z chloridu palladnatého a chloridu sodného) ve směsi vody a methanolu a s allylchloridem.[2]
- 2 Na2PdCl4 + 2 CH2=CHCH2Cl + 2 CO + 2 H2O → [(η3-C3H5)PdCl]2 + 4 NaCl + 2 CO2 + 4 HCl
Další možností je reakce propenu s trifluoroctanem palladnatým a následná výměna iontů za chlorid:[4]
- 2 (CF3COO)2Pd + 2 CH2=CHCH3 → [(η3-C3H5)Pd(CF3COO)]2
- [(η3-C3H5)Pd(CF3COO)]2 + 2 Cl− → [(η3-C3H5)PdCl]2 + 2 CF3COO−
Reakce
APC reaguje se zdroji cyklopentadienylových aniontů za vzniku příslušných 18elektronových komplexů cyklopentadienylallylpalladia:
- [(η3-C3H5)PdCl]2 + 2 NaC5H5 → 2 [(η5-C5H5)Pd(η3-C3H5)] + 2 NaCl
Dimer může reagovat s mnoha různými Lewisovými zásadami (:B) za vzniku aduktů (η3-C3H5)PdCl:B. S pyridinem reaguje podle této rovnice:
- 1/2 [(η3-C3H5)PdCl]2 + :NC5H5 → (η3-C3H5)PdCl:NC5H5 ΔH=−30,1 kJ/mol
Uvedená změna entalpie odpovídá vzniku jednoho molu produktu, (η3-C3H5)PdCl:NC5H5, z dimeru kyseliny. Disociační energie palladnatého dimeru, tedy energie působící před reakcí s donorem:
- [(η3-C3H5)PdCl]2 → 2 (η3-C3H5)PdCl
je 28 kJ/mol.
APC katalyzuje řadu organických reakcí, jako jsou křížová párování, nukleofilní adice na dieny a rozklad diazosloučenin na reaktivní karbeny. Jedná se též o prekurzor dalších katalyzátorů založených na palladiu.[4]
Reference
V tomto článku byl použit překlad textu z článku Allylpalladium chloride dimer na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/61538
- ↑ a b Tatsuno, Y.; Yoshida, T.; Otsuka, S. "(η3-allyl)palladium(II) Complexes" Inorganic Syntheses, 1990, volume 28, pages 342-345. ISBN 0-471-52619-3
- ↑ A. E. Smith. The structure of the allylpalladium chloride complex (C3H5PdCl)2 at –140 °C. Acta Crystallographica. 1965, s. 331–340. Dostupné online. ISSN 0365-110X. doi:10.1107/S0365110X65000774.
- ↑ a b Stephen A. Godleski; Véronique Michelet; Jean-Pierre Genêt. Encyclopedia of Reagents for Organic Synthesis. Chichester, UK: John Wiley & Sons, 2006. Dostupné online. ISBN 978-0-471-93623-7. doi:10.1002/047084289x.rb098s.pub2. Kapitola Bis(allyl)di-μ-chlorodipalladium.
Externí odkazy
- Obrázky, zvuky či videa k tématu Dimer chloridu allylpalladnatého na Wikimedia Commons


