Chlorid yttritý
| Chlorid yttritý | |
|---|---|
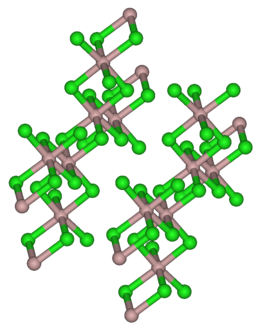 Struktura krystalů chloridu yttritého, podobná struktuře chloridu hlinitého
| |
| Obecné | |
| Systematický název | Chlorid yttritý |
| Anglický název | Yttrium(III) chloride Yttrium trichloride |
| Německý název | Yttrium(III)-chlorid |
| Sumární vzorec | YCl3 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 10361-92-9 |
| SMILES | Cl[Y](Cl)Cl |
| InChI | InChI=1S/3ClH.Y/h3*1H;/q;;;+3/p-3 1/3ClH.Y/h3*1H;/q;;;+3/p-3 |
| Číslo RTECS | ZG3150000 |
| Vlastnosti | |
| Molární hmotnost | 195,26 g/mol |
| Teplota tání | 721 °C |
| Teplota varu | 1 507 °C |
| Hustota | 2,67 g/cm3 |
| Rozpustnost ve vodě | 82 g/100 ml |
| Rozpustnost v polárních rozpouštědlech |
ethanol 60,1 g/100 ml (15 °C) |
| Rozpustnost v nepolárních rozpouštědlech |
pyridin 60,6 g/100 ml (15 °C) |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Bezpečnost | |
| Teplota vznícení | nehořlavý |
|
Některá data mohou pocházet z datové položky.
| |
Chlorid yttritý (YCl3) je sloučenina yttria a chloru. Jedná se o pevnou látku, která je dobře rozpustná jak v polárních (voda, ethanol), tak i v nepolárních (pyridin...) rozpouštědlech
Vlastnosti
Chlorid yttritý existuje ve dvou formách, bezvodý YCl3 a také jako hexahydrát YCl3·6 H2O, obě formy jsou bílé pevné a dobře rozpustné látky. Jeho krystalická struktura je podobná struktuře mnoha sloučenin jako například AlCl3.
Příprava
YCl3 se připravuje z Y2O3[1][2] nebo YCl3·6 H2O[3] a chloridu amonného, přičemž u obou postupů vzniká jako komplexní meziprodukt (NH4)2[YCl5]:
10 NH4Cl + Y2O3 → 2 (NH4)2[YCl5] + 6 NH3 + 3 H2O
YCl3·6H2O + 2 NH4Cl → (NH4)2[YCl5] + 6 H2O
Meziprodukt se následně rozloží zahřátím podle rovnice:
(NH4)2[YCl5] → 2 NH4Cl + YCl3
Reakcí oxidu yttritého s HCl vzniká hexahydrát, ze kterého nelze připravit bezvodý YCl3 zahřátím, místo toho vzniká oxychlorid.
Podobné sloučeniny
- fluorid yttritý
- bromid yttritý
- jodid yttritý
- chlorid skanditý
- chlorid lanthanitý
- chlorid aktinitý
Reference
V tomto článku byl použit překlad textu z článku Yttrium(III) chloride na anglické Wikipedii.
- ↑ MEYER, G. The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. Inorganic Syntheses. 1989, s. 146–150. ISBN 978-0-470-13256-2. DOI 10.1002/9780470132562.ch35.
- ↑ EDELMANN, F. T.; POREMBA, P. Synthetic Methods of Organometallic and Inorganic Chemistry. Redakce Herrmann, W. A. (ed.). Stuttgart: Georg Thieme Verlag, 1997. ISBN 3-13-103021-6.
- ↑ TAYLOR, M.D.; CARTER, C.P. Preparation of anhydrous lanthanide halides, especially iodides. Journal of Inorganic and Nuclear Chemistry. S. 387–391. DOI 10.1016/0022-1902(62)80034-7.
Externí odkazy
- Obrázky, zvuky či videa k tématu chlorid yttritý na Wikimedia Commons

