Vliv sousední skupiny
Jako vliv sousední skupiny se označuje souhrn interakcí reakčního centra s volnými elektronovými páry atomů nebo elektrony vazeb sigma či pí obsaženými v dané molekule, ale ne konjugovaných s reakčním centrem.[1][2][3]
Tyto interakce často navyšují rychlosti reakcí a ovlivňují také stereochemické vlastnosti reakce.
Vliv volných elektronových párů heteroatomů
Při substitucích molekul obsahujících heteroatomy se jedna ze skupin substrátu podílí na reakci a ovlivňuje tak její průběh. Příkladem může být reakce sirného yperitu nebo dusíkatých yperitů s nukleofily, které jsou sloučeniny výrazně rychlejší než u nukleofilů obsahujících sekundární či primární alkylchloridy bez heteroatomů v hlavním řetězci.[4]

Ph-S-CH2-CH2-Cl reaguje s vodou 600krát rychleji než CH3-CH2-CH2-Cl.[4]
Vliv alkenových skupin
Orbitaly π u alkenů mohou stabilizovat přechodné stavy usnadněním delokalizace kladného náboje karbokationtu; například nenasycené tosyláty reagují rychleji (1011krát rychleji při solvolýze ve vodě) než nasycené.
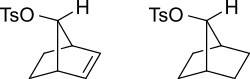
Karbokationtové meziprodukty lze stabilizovat rezonancemi, kde je kladný náboj rozprostřen na více atomech:


Tento účinek se objevuje i u alkenů, kde je vzdálenost dvojné vazby od reakčního centra větší; například u následujícího alkylovaného benzensulfonátu alken vyvolává delokalizaci karbokationtu.

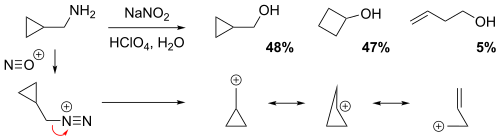
Vliv cyklopropanových, cyklobutanových, a homoallylových skupin
Reakcí cyklopropylmethaminu s dusitanem sodným ve zředěné kyselině chloristé vznikala směs obsahující 48 % cyklopropylmethylalkoholu, 47 % cyklobutanolu, a 5 % homoallylového alkoholu but-3-en-1-olu.[5]
Kladný náboj je prostřednictvím rezonančních struktur delokalizován přes karbokationtový meziprodukt, čímž vznikají částečné (na elektrony chudé) vazby. Nízká výnosnost homoallylového alkoholu naznačuje, že homoallylové struktury mají nejmenší podíl.
Působení aromatických kruhů
Aromatické kruhy se mohou delokalizací kladných nábojů podílet na tvorbě karbokationtů nazývaných fenoniové ionty.

Reakcí tosylátu, znázorněné na následujícím obrázku, s kyselinou octovou za solvolýzy namísto jednoduché SN2 reakce, se vytvářela směs produktů A,B (navzájem enantiomerních), a C+D, v poměru 48:48:4.[6][7]

Mechanismus tvorby A a B vypadá takto:

Působení alifatických vazeb C-C nebo C-H
Alifatické vazby C-C a C-H vyvolávají delokalizace, nacházejí-li se v blízkosti odstupujících skupin. Meziprodukty příslušných reakcí, například 2-norbornylové kationty, se označují jako neklasické ionty.
Reference
V tomto článku byl použit překlad textu z článku Neighbouring group participation na anglické Wikipedii.
- ↑ Jerry March. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. [s.l.]: [s.n.], 1992. ISBN 978-0-471-60180-7. S. 314.
- ↑ J- F- de Rooij; G. Wille-Hazeleger; P. M. Burgers; J. H. van Boom. Neighbouring group participation in the unblocking of phosphotriesters of nucleic acids. Nucleic Acids Research. 1979, s. 2237–2259.
- ↑ Susanne A. Stalford; Colin A. Kilner; Andrew G. Leach; W. Bruce Turnbull. Neighbouring group participation vs. addition to oxacarbenium ions: studies on the synthesis of mycobacterial oligosaccharides. Organic and Biomolecular Chemistry. 2009-12-07, s. 4842–4852. doi:10.1039/B914417J. PMID 19907773.
- ↑ a b Jonathan Clayden; Nick Greeves; Stuart G. Warren. Organic chemistry. Oxford; New York: Oxford University Press, 2012. Dostupné online. ISBN 978-0-19-927029-3. S. 932.
- ↑ J. D. Roberts; R. H. Mazur. Small-Ring Compounds. IV. Interconversion Reactions of Cyclobutyl, Cyclopropylcarbinyl and Allylcarbinyl Derivatives. Journal of the American Chemical Society. 1951, s. 2509–2520. doi:10.1021/ja01150a029.
- ↑ Donald J. Cram. Studies in Stereochemistry. I. The Stereospecific Wagner--Meerwein Rearrangement of the Isomers of 3-Phenyl-2-butanol. Journal of the American Chemical Society. 1949, s. 3863–3870. doi:10.1021/ja01180a001. Bibcode 1949JAChS..71.3863C.
- ↑ Donald J. Cram. Studies in Stereochemistry. V. Phenonium Sulfonate Ion-pairs as Intermediates in the Intramolecular Rearrangements and Solvolysis Reactions that Occur in the 3-Phenyl-2-butanol System. Journal of the American Chemical Society. 1952, s. 2129–2137. doi:10.1021/ja01129a001.

