Trimethylsilylchlorid
| Trimethylsilylchlorid | |
|---|---|
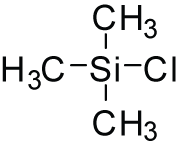 Strukturní vzorec
| |
 Tyčinkovo-kuličkový model molekuly
| |
| Obecné | |
| Systematický název | chlortrimethylsilan |
| Ostatní názvy | trimethylsilylchlorid, TMSCL |
| Anglický název | Trimethylsilyl chloride |
| Funkční vzorec | (CH3)3SiCl |
| Sumární vzorec | C3H9SiCl |
| Vzhled | bezbarvá kapalina, dýmavá na vlhkém vzduchu |
| Identifikace | |
| Registrační číslo CAS | 75-77-4 |
| PubChem | 6397 |
| SMILES | C[Si](C)(C)Cl |
| InChI | InChI=1S/C3H9ClSi/c1-5(2,3)4/h1-3H3 |
| Číslo RTECS | VV2710000 |
| Vlastnosti | |
| Molární hmotnost | 108,64 g/mol |
| Teplota tání | −40 °C (233 K) |
| Teplota varu | 57 °C (330 K) |
| Rozpustnost ve vodě | reaguje |
| Měrná magnetická susceptibilita | −7,12×105 μm3/g |
| Struktura | |
| Tvar molekuly | čtyřstěn s centrem v atomu Si |
| Bezpečnost | |
|
[1] Nebezpečí[1] | |
| R-věty | R11 R14 R20 R21 R35 R37 |
| S-věty | S16 S26 S36 S37 S39 S45 |
| Teplota vzplanutí | −28 °C (245 K) |
| Teplota vznícení | 400 °C (673 K) |
|
Některá data mohou pocházet z datové položky.
| |
Trimethylsilylchlorid, také nazývaný chlortrimethylsilan, zkráceně TMSCL, je organická sloučenina křemíku, halogenderivát silanu. Jedná se o bezbarvou těkavou kapalinu, která je stabliní za nepřítomnosti vody. Má široké využití v organické chemii.
Příprava
TMSCL se připravuje reakcí methylchloridu se slitinou křemíku a mědi. Hlavním cílem tohoto procesu je získání dimethyldichlorsilanu, ovšem vznikají také významná množství trimethylových a monomethylových produktů. Odpovídající reakce jsou (Me = CH3):
- x MeCl + Si → Me3SiCl, Me2SiCl2, MeSiCl3...
2-4 % získaných produktů tvoří monochlorid, který vytváří azeotropní směs s MeSiCl3.
Reakce a použití
TMSCL snadno reaguje s nukleofily, přičemž je z jeho molekuly odstraněna chloridová skupina. Při jedné z typických reakcí je nukleofilem voda a dochází k hydrolýze za vzniku hexamethyldisiloxanu:
- 2 Me3SiCl + H2O → Me3Si-O-SiMe3 + 2 HCl
Obdobnou reakci s alkoholy lze využít k tvorbě bezvodých roztoků kyseliny chlorovodíkové v alkoholech, které se používají při mírné syntéze nitrilů nebo esterů z karboxylových kyselin stejně jako na přípravu acetalů z ketonů. Trimethylsilylchlorid se také používá na silanizaci laboratorního skla, díky čemuž jsou povrchy více lipofilní.
Silylace v organické syntéze
Při silylaci polární funkční skupiny jako alkoholy a aminy snadno reagují s trimethylsilylchloridem za vzniku trimethylsilyletherů a trimethylsilylaminů. Tyto připojené skupiny „ochraňují“ původní skupiny odstraněním labilních protonů a snížením zásaditosti heteroatomu. Chránicí skupiny (zde Me3Si-O a Me3Si-N) lze později odstranit (což se nazývá „deprotekce“). Trimethylsilylace může být také použita na zvýšení těkavosti sloučeniny, čímž se dá provést plynová chromatografie i u jinak netěkavých látek jako je glukóza. TMSCL rovněž reaguje s acetylidy kovů za vzniku trimethylsilylalkynů jako je například bis(trimethylsilyl)acetylen.
Za přítomnosti triethylaminu a diisopropylamidu lithného jsou enolizovatelné aldehydy, ketony a estery převáděny na trimethylsilylenolové ethery. I přes jejich hydrolytickou nestabilitu mají tyto sloučeniny značné využití v organické chemii; zoxidováním dvojné vazby epoxidací nebo dihydroxylací lze obnovit původní karbonylové skupiny s alkoholovou skupinou na alfa uhlíku. Trimethylsilylenolové ethery mohou být rovněž použity jako maskované ekvivalenty enolátů v Mukaiyamově aldolové adici.
Ostatní reakce
Trimethylsilylchlorid se používá na přípravu trimethylsilylhalogenidů a pseudohalogenidů jako jsou trimethylsilylfluorid, trimethylsilylbromid, trimethylsilyljodid, trimethylsilylkyanid, trimethylsilylazid a trimethylsilyltriflát (TMSOTf). Tyto látky se tvoří podvojnou záměnou mezi trimethylsilylchloridem a (pseudo)halogenidem (MX):
- MX + Me3Si-Cl → MCl + Me3Si-X
TMSCl, lithium a molekulární dusík vzájemně reagují za vzniku tris(trimethylsilyl)aminu (katalyzátorem je nichromový drát nebo chlorid chromitý):
- 6 Me3SiCl + 6 Li + N2 → 2 (Me3Si)3N + 6 LiCl
Touto reakcí lze do organického substrátu zavést vzdušný dusík; například tris(trimethylsilyl)amin reaguje s α,δ,ω-triketony za vzniku tricyklických pyrrolů.[2]
Redukcí trimethylsilylchloridu vzniká hexamethyldisilan:
- 2 Me3SiCl + 2 Na → 2 NaCl + Me3Si-SiMe3
Reference
V tomto článku byl použit překlad textu z článku Trimethylsilyl chloride na anglické Wikipedii.
- ↑ a b Chlorotrimethylsilane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ BROOK, Michael A. Silicon in Organic, Organometallic, and Polymer Chemistry. New York: John Wiley & Sons, 2000. S. 193–194.
Externí odkazy
- Obrázky, zvuky či videa k tématu Trimethylsilylchlorid na Wikimedia Commons






