Methyljodid
| Jodmethan | |
|---|---|
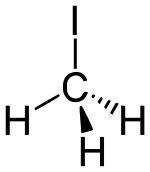 Strukturní vzorec
| |
 Tyčinkovo-kuličkový model molekuly
| |
 Kalotový model molekuly
| |
| Obecné | |
| Systematický název | jodmethan |
| Ostatní názvy | monojodmethan, methyljodid |
| Anglický název | Iodomethane |
| Německý název | Iodmethan |
| Sumární vzorec | CH3I |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 74-88-4 |
| EC-no (EINECS/ELINCS/NLP) | 200-819-5 |
| PubChem | 6328 |
| ChEBI | 39282 |
| UN kód | 2644 |
| SMILES | CI |
| InChI | InChI=1/CH3I/c1-2/h1H3 |
| Číslo RTECS | PA9450000 |
| Vlastnosti | |
| Molární hmotnost | 141,939 g/mol |
| Teplota tání | −66,5 °C (206,6 K) |
| Teplota varu | 42,4 až 42,8 °C (315,6 až 316,0 K) |
| Hustota | 2,28 g/cm3 |
| Index lomu | 1,530 až 1,531 |
| Rozpustnost ve vodě | 1,4 g/100 ml (20 °C) |
| Tlak páry | 54,4 kPa (20 °C) |
| Měrná magnetická susceptibilita | −4,03×105 μm3/g |
| Struktura | |
| Tvar molekuly | čtyřstěnný |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −14,1 až −13,1 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −808,9 až −808,3 kJ/mol |
| Měrné teplo | 82,75 J⋅K−1⋅mol−1 |
| Bezpečnost | |
|
[1] Nebezpečí[1] | |
| H-věty | H301 H312 H315 H331 H335 H351 |
| P-věty | P261 P280 P301+310 P311 |
|
Některá data mohou pocházet z datové položky.
| |
Jodmethan (též methyljodid nebo monojodmethan, zkratkou MeI) je organická sloučenina se vzorcem CH3I. Patří mezi halogenderiváty uhlovodíků, jeho molekula vychází z molekuly methanu, kde je jeden atom vodíku nahrazen atomem jodu. Za běžných podmínek má jodmethan podobu husté bezbarvé těkavé kapaliny mísitelné s organickými rozpouštědly. V malém množství vzniká přirozeně v rostlinách rýže.[2] Využívá se v organické syntéze k methylaci. Kontroverzním rozhodnutím EPA v roce 2007 byl také schválen jako pesticid.[3]
Vlastnosti
Jodmethan je bezbarvá kapalina, relativně těkavá (teplota varu 41–43 °C). Rozpouští se v mnoha organických rozpouštědlech. Podobně jako mnoho jiných organojodidových sloučenin je potřeba ho uchovávat ve tmavých láhvích, protože se na světle rozkládá; uvolňovaný jod barví kapalinu purpurově. Komerční produkty mohou být stabilizovány měděným nebo stříbrným drátem.[4]
Reference
V tomto článku byl použit překlad textu z článku Methyl iodide na anglické Wikipedii.
- ↑ a b Iodomethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone. Emissions of Methyl Halides and Methane from Rice Paddies. Science. 2000, s. 966–969. DOI 10.1126/science.290.5493.966. PMID 11062125.
- ↑ Zitto, Kelly Methyl iodide gains state OK for use on crops. San Francisco Chronicle. December 2, 2010. Dostupné online.
- ↑ SULIKOWSKI, Gary A.; SULIKOWSKI, Michelle M.; HAUKAAS, Michael H.; MOON, Bongjin. e-EROS. Iodomethane. [s.l.]: [s.n.], 2005. DOI 10.1002/047084289X.ri029m.pub2.
Literatura
- Sulikowski, G. A.; Sulikowski, M. M. (1999). in Coates, R.M.; Denmark, S. E. (Eds.) Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation New York: Wiley, pp. 423–26.
- Bolt H. M., Gansewendt B. Mechanisms of carcinogenicity of methyl halides.. Crit Rev Toxicol.. 1993, s. 237–53. DOI 10.3109/10408449309105011. PMID 8260067.
Externí odkazy
- Obrázky, zvuky či videa k tématu Jodmethan na Wikimedia Commons
- IARC Summaries & Evaluations: Vol. 15 (1977), Vol. 41 (1986), Vol. 71 (1999)
- Metabolism of iodomethane in the rat
- Iodomethane NMR spectra
- JONES, Nicola. Strawberry pesticide leaves sour taste: Methyl iodide use by Californian farmers up for review.. Nature News. September 24, 2009. Dostupné online [cit. September 25, 2009].




