Hydrogensíran sodný
| Hydrogensíran sodný | |
|---|---|
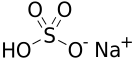 Vzorec
| |
 Model
| |
 Vzhled, je přiložen i pH papírek dokazující nízké pH
| |
| Obecné | |
| Systematický název | Hydrogensíran sodný |
| Ostatní názvy | Bisulfát sodný (zastaralý název) |
| Sumární vzorec | NaHSO4 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7681-38-1 |
| Vlastnosti | |
| Molární hmotnost | 120,06 g/mol (bezvodý) 138,07 g/mol (monohydrát) |
| Teplota tání | 58,5 °C; tj. 331,5 K (monohydrát) 315 °C; tj. 558 K (bezvodý) |
| Teplota rozkladu | 315 °C; 588 K (na H2O a Na2S2O7) |
| Hustota | 2,742 g/cm3 (bezvodý) 1,8 g/cm3 (monohydrát) |
| Disociační konstanta pKa | 1,99 |
| Rozpustnost ve vodě | 50 g/100 ml (0 °C) 100 g/100 ml (100 °C) |
| Struktura | |
| Krystalová struktura | jednoklonná (monohydrát); trojklonná (bezvodý) |
| Bezpečnost | |
|
[1] Nebezpečí[1] | |
| H-věty | H318 |
| R-věty | R34 R37 R41 |
| S-věty | S26 S36 S37 S39 S45 |
| NFPA 704 |  0
1
1
|
|
Některá data mohou pocházet z datové položky.
| |
Hydrogensíran sodný je bílá krystalická anorganická látka se vzorcem NaHSO4. Jedná se o sodnou sůl kyseliny sírové, kde je nahrazen jen jeden ze dvou vodíků sodíkem, což způsobuje, že pH jeho vodných roztoků je kyselé (1molární roztok dosahuje pH cca 1).
Výroba
Tato látka je obvykle vyráběna reakcí hydroxidu sodného a kyseliny sírové, dle rovnice:
Důležité pro tuto reakci je, že není použito velké množství hydroxidu sodného, aby nedocházelo ke vzniku síranu sodného. Reakce probíhá se zředěnými, zahřátými roztoky, které jsou v průběhu míchány.
Obdobně lze použít místo hydroxidu chlorid. Reakce pak probíhá následně:
Vzniklý produkt je obvykle kontaminovanější (v porovnání s hydroxidovou výrobou), avšak je mnohem levnější díky nízké ceně a vysoké dostupnosti chloridu sodného.
Reakce
Tato látka se chová velice obdobně jako kyselina sírová. Z mnoha látek (kupříkladu z octanu sodného) přebíhá sodný iont a nahrazuje ho svým vodíkovým iontem, reaguje tedy:
Tato reakce může probíhá obdobně s uhličitanem, chloridem, fosforečnanem, dusičnanem, a jinými látkami.
Tato látka se při zahřívání na vysokou teplotu (t>315 °C) rozkládá, vzniká disíran sodný a voda, dle rovnice:
Tato reakce je však vratná.
Použití
Tato látka se běžně používá na snižování pH, je totiž méně nebezpečná v porovnání třeba s kyselinou sírovou. Hydrogensíran sodný se používá jako přídatná látka (spolu se síranem sodným pod označením E 514). Dále bývá používán jako dezinfekce bazénů, zabraňuje totiž množení bakterií.
Reference
- ↑ a b Sodium hydrogen sulfate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
- Obrázky, zvuky či videa k tématu Hydrogensíran sodný na Wikimedia Commons





![{\displaystyle \mathrm {2\,NaHSO_{4}\ {\xrightarrow[{}]{t}}\ Na_{2}S_{2}O_{7}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbe3aea3ed02469f3760f11ff57c5d3e0dbbbae2)
