Greenova–Daviesova–Mingosova pravidla
Greenova–Daviesova–Mingosova pravidla označují soubor pravidel určujících regioselektivitu nukleofilních adicí na 18elektronové komplexy kovů obsahující více nenasycených ligandů.[1] Vydali je v roce 1978 organokovoví chemici Stephen G. Davies, Malcolm Green, a Michael Mingos za účelem popisu, jak a kde bývají nenasycené uhlovodíky v komplexech náchylnější k nukleofilním atakům.[1]
První pravidlo
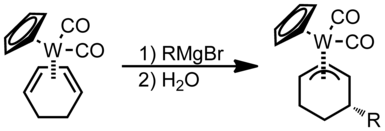
Nukleofilní atak probíhá převážně na polyenech se sudými počty atomů v cyklech (i podle hapticity).[1]

Druhé pravidlo
Nukleofily se snadněji navazují na acyklické polyeny než na cyklické.[1]

Třetí pravidlo
Nukleofily se na polyenové ligandy se sudou hapticitou nejsnadněji navazují na koncích.[1] Na acyklické polyenové ligandy s lichou hapticitou se nukleofily navazují na koncových pozicích pokud je kov silně elektrofilní, jinak se navazují do vnitřních poloh.
Následující diagram znázorňuje obecnou reaktivitu π-ligandů s ohledem na sudou/lichou hapticitu a otevřenost/uzavřenost řetězců:
Kovové centrum odtahuje elektrony; tento jev je výraznější, pokud je na kov také navázán karbonyl. Kovy chudé na elektrony nejsou pro karbonyly dobrými donory. Čím silněji kov odtahuje elektrony, tím se povaha vazby CO ligandu více blíží trojné vazbě.
U kovu s navázaným obecným ligandem a karbonylem má karbonyl částečný kladný náboj a je tak náchylný k nukleofilním atakům. Pokud je ligandem Ln π-ligand, může být také aktivován vůči nukleofilním atakům.
Reakce s nukleofilem probíhá na jednom z konců π-systému:
V tomto případě je možné považovat kruh za analog buta-1,3-dienu. Podle Greenových–Daviesových–Mingosových pravidel by nukleofilní atak, protože je butadien otevřeným π-ligandem o sudé hapticitě, měl probíhat na jednom z konců π-systému, jelikož LUMO butadienu má větší laloky na koncích než na vnitřních pozicích.
Vliv druhu ligandu na regioselektivitu
Nukleofilní ataky u allylových sloučenin s pí-akceptorovými ligandy probíhají na koncích molekul.[2]
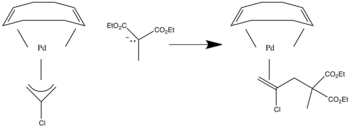
Když jsou přítomny sigma-donorové ligandy, tak posílají elektrony na ligand a ataky probíhají na vnitřních pozicích.

Vliv asymetrických ligandů
Za přítomnosti asymetrických allylových ligandů převažují nukleofilní ataky na více substituovaných místech.[3]

V případě na obrázku výše atak nastane na uhlíku se dvěma navázanými skupinami R, jelikož má tento uhlík větší míru substituce.
Syntetická využití
Nukleofilní adice na π ligandy mohou mít syntetická využití, například v přípravách metalocyklických sloučenin.[4]
Nukleofily se napojují na centrum π ligandu a vytváří metalobutan.


Odkazy
Reference
V tomto článku byl použit překlad textu z článku Green–Davies–Mingos rules na anglické Wikipedii.
- ↑ a b c d e Stephen G. Davies; Malcolm L. H. Green; D. Michael P. Mingos. Nucleophilic Addition to Organotransition Metal Cations Containing Unsaturated Hydrocarbon Ligands: A Survey and Interpretation. Tetrahedron. 1978, s. 3047–3077. doi:10.1016/0040-4020(78)87001-X.
- ↑ Attila Aranyos; Kálmán J. Szabó; Ana M. Castaño; Jan-E. Bäckvall. Central versus Terminal Attack in Nucleophilic Addition to (π-Allyl)palladium Complexes. Ligand Effects and Mechanism. Organometallics. 1997, s. 1058–1064. doi:10.1021/om960950m.
- ↑ F. Delbecq; C. Lapouge. Regioselectivity of the Nucleophilic Addition to (η3-allyl) Palladium Complexes. A Theoretical Study. Organometallics. 2000, s. 2716–2723. doi:10.1021/om0003032.
- ↑ Roy A. Periana. Carbon-carbon activation of organic small ring compounds by arrangement of cycloalkylhydridorhodium complexes to rhodacycloalkanes. Synthesis of metallacyclobutanes, including one with a tertiary metal-carbon bond, by nucleophilic addition to π-allyl complexes. Journal of the American Chemical Society. 1986, s. 7346–7355. doi:10.1021/ja00283a033.
Literatura
- Roy A. Periana; Robert G. Bergman. Rapid intramolecular rearrangement of a hydrido(cyclopropyl)rhodium complex to a rhodacyclobutane. Independent synthesis of the metallacycle by addition of hydride to the central carbon atom of a cationic rhodium π-allyl complex. Journal of the American Chemical Society. 1984, s. 7272–7273. doi:10.1021/ja00283a033.
- Tomohiro Suzuki; Goro Okada; Yasunori Hioki; Hiroshi Fujimoto. Theoretical Study of the Reactivity of (π-Allyl)molybdenum Complexes. Organometallics. 2003, s. 3649–3658. doi:10.1021/om0207459.
- Sonja Schörshusen; Jürgen Heck. Metal-Mediated Transformations of Cyclooctatetraene to Novel Methylene-Bridged, Bicyclic Compounds. Organometallics. 2007, s. 5386–5394. doi:10.1021/om700539e.