Dewarův benzen
| Dewarův benzen | |
|---|---|
 Strukturní vzorec
| |
 Model molekuly
| |
| Obecné | |
| Systematický název | bicyklo[2.2.0]hexa-2,5-dien |
| Sumární vzorec | C6H6 |
| Identifikace | |
| Registrační číslo CAS | 5649-95-6 |
| PubChem | 98808 |
| SMILES | C\1=C\C2/C=C\C/12 |
| InChI | InChI=1S/C6H6/c1-2-6-4-3-5(1)6/h1-6H |
| Vlastnosti | |
| Molární hmotnost | 78,112 g/mol |
|
Některá data mohou pocházet z datové položky.
| |
Dewarův benzen (systematicky bicyklo[2.2.0]hexa-2,5-dien je bicyklický uhlovodík, izomer benzenu, s sumárním vzorcem C6H6. Pojmenován je po Jamesi Dewarovi, který jej navrhl v roce 1869, ne ale jako strukturu benzenu.[1]
Struktura a vlastnosti
Na rozdíl od benzenu není molekula Dewarova benzenu rovinná, protože uhlíky v místech spojení kruhů jsou navázány na čtyři atomy namísto tří, což vede k tetraedrické geometrii a dva cyklobutenové kruhy jsou tak o určitý úhel vychýleny. Sloučenina vykazuje výrazné kruhové napětí a izomerizuje se na benzen s poločasem dvou dnů; pomalý průběh této přeměny je způsoben tím, že je symetricky zakázaná.[2]
Příprava
Tato sloučenina byla poprvé připravena roku 1962 jako terc-butylovaný derivát[3] a v roce 1963 jako nesubstituovaná fotolýzou cis-1,2-dihydroderivátu ftalanhydridu a následnou oxidací octanem olovičitým.[4][5]
Srovnání s benzenem

Tuto strukturu navrhl Dewar jako jeden ze sedmi možných izomerů[6] a na základě svých pokusů předpokládal platnost struktury, kterou navrhl Friedrich August Kekulé.[1]
Po vyvinutí teorie valenčních vazeb v roce 1928 začal být benzen popisován pomocí dvou hlavních kekulovských rezonančních struktur. Tři možné Dewarovy struktury přispívají, podobně jako například prisman, benzvalen, a Clausův benzen, malým podílem; prisman a benzvalen byly připraveny během 70. let a Clausův benzen benzen není možné připravit.[7]
Hexamethylovaný Dewarův benzen
Hexamethylovaný Dewarův benzen byl získán bicyklotrimerizací dimethylacetylenu za katalýzy chloridem hlinitým.[8] Za přítomnosti HCl se přesmykuje na dimer pentamethylcyklopentadienylchloridu rhoditého[9][10][11][12] nebo pentamethylcyklopentadienylchloridu iriditého;[13] lze jej tak využít při přípravě některých pentamethylcyklopentadienylových komplexů,[14][15] například [Cp*Rh(CO)2].[16]
Při pokusu o obdobnou reakci s tetrachloroplatnatanem draselným se vytváří pentamethylcyklopentadienový komplex [(η4-Cp*H)PtCl2], což naznačuje, že pro vytvoření aromatického aniontu je nutná přítomnost rhodia nebo iridia.[12]
![Příprava rhoditého dimeru [Cp*RhCl2]2 z hexamethyldewarova benzenu](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/Hexamethyl_Dewar_benzene_reacting_with_rhodium_chloride_under_acidic_conditions.PNG/960px-Hexamethyl_Dewar_benzene_reacting_with_rhodium_chloride_under_acidic_conditions.PNG)
Jednu z alkenových skupin lze epoxidovat pomocí kyseliny m-chlorperoxybenzoové,[17]kyseliny peroxobenzoové,[18] nebo dimethyldioxiranu;[19] při použití peroxokyseliny se produkt rychle přesmykuje, přičemž katalyzátorem je vedlejší produkt epoxidace.[17]

Dimethyldioxiran vytváří stabilní produkt, jelikož je u něj vedlejším produktem neutrální aceton. V závislosti na použitém množství dimethyldioxiranu může vznikat mono- nebo diepoxid, s atomy kyslíku v bicyklickém řetězci v poloze exo.[19]

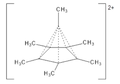
V roce 1973 byl připraven dikation hexamethylbenzenu, C6(CH3) 2+
6 ,[20]
který lze získat rozpuštěním monoepoxidu hexamethyldewarova benzenu v magické kyselině, která odštěpuje kyslík v podobě aniontu.[21]
Struktura byla určena jako pentagonálně pyramidální, pomocí NMR s využitím dat o podobném kationtu.[22] Vrcholový uhlík je navázán na šest dalších atomů uhlíku, což bylo zjištěno rentgenovou krystalografickou analýzou hexafluorantimoničnanu.[21]

-
-
![Trojrozměrný model přesmyknutého pentagonálně bipyramidálního dikationtu[21]](//upload.wikimedia.org/wikipedia/commons/thumb/1/1f/C6%28CH3%296%282%2B%29_3D_skeletal.png/120px-C6%28CH3%296%282%2B%29_3D_skeletal.png) Trojrozměrný model přesmyknutého pentagonálně bipyramidálního dikationtu[21]
Trojrozměrný model přesmyknutého pentagonálně bipyramidálního dikationtu[21]
Slabé vazby vycházející z horního vrcholu jehlanů mají Wibergův řád vazby kolem 0,54; celkový řád vazby vrcholového uhlíku činí 5 × 0,54 + 1 = 3,7 < 4, a molekula tak není hypervalentní, ale je hyperkoordinovaná.[23] Sloučenina je tvořena kationtem C4+ vázaným k η5–pentamethylcyklopentadienylovému aniontu (jenž je donorem šesti elektronů) a methylovému aniontu (donor dvou elektronů), čímž molekula splňuje oktetové pravidlo[24] a je analogem plynného monomeru organozinečnaté sloučeniny [(η5–C5(CH3)5)ZnCH3)], obsahující tytéž ligandy navázané na zinečnaté (Zn2+) centrum, kde kov splňuje pravidlo 18 elektronů.[25][26]; struktura tak, i když je neobvyklá,[21] neporušuje běžná pravidla pro chemické vazby.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Dewar benzene na anglické Wikipedii.
- ↑ a b Wilson Baker; Dennis H. Rouvray. Para-Bond or "Dewar" Benzene?. Journal of Chemical Education. 1978, s. 645. doi:10.1021/ed055p645. Bibcode 1978JChEd..55..645B.
- ↑ James O. Jensen. Vibrational Frequencies and Structural Determination of Dewar Benzene. Journal of Molecular Structure: THEOCHEM. 2004, s. 227–236. Dostupné online. doi:10.1016/j.theochem.2004.03.042.
- ↑ Eugene E. van Tamelen; S. P. Pappas. Chemistry of Dewar Benzene. 1,2,5-Tri-t-Butylbicyclo[2.2.0]Hexa-2,5-Diene. Journal of the American Chemical Society. 1962, s. 3789–3791. doi:10.1021/ja00878a054.
- ↑ Eugene E. van Tamelen; S. P. Pappas. Bicyclo [2.2.0]hexa-2,5-diene. Journal of the American Chemical Society. 1963, s. 3297–3298. doi:10.1021/ja00903a056.
- ↑ Eugene E. van Tamelen; S. P. Pappas; K. L. Kirk. Valence Bond Isomers of Aromatic Systems. Bicyclo[2.2.0]hexa-2,5-dienes (Dewar benzenes). Journal of the American Chemical Society. 1971, s. 6092–6101. doi:10.1021/ja00752a021.
- ↑ James Dewar. On the Oxidation af Phenyl Alcohol, and a Mechanical Arrangement adapted to illustrate Structure in the Non-saturated Hydrocarbons. Proceedings of the Royal Society of Edinburgh. 1869, s. 82–86. doi:10.1017/S0370164600045387.
- ↑ Roald Hoffmann; Henning Hopf. Learning from Molecules in Distress. Angewandte Chemie International Edition. 2008, s. 4474–4481. doi:10.1002/anie.200705775. PMID 18418829.
- ↑ SHAMA, Sami A.; WAMSER, Carl C. Hexamethyl Dewar Benzene. Org. Synth.. 1990, s. 62. Dostupné online. doi:10.15227/orgsyn.061.0062.; Coll. Vol.. S. 256.
- ↑ Leo A. Paquette; Grant R. Krow. Electrophilic Additions to Hexamethyldewarbenzene. Tetrahedron Letters. 1968, s. 2139–2142. doi:10.1016/S0040-4039(00)89761-0.
- ↑ Rudolf Criegee; H. Grüner. Acid-catalyzed Rearrangements of Hexamethyl-prismane and Hexamethyl-Dewar-benzene. Angewandte Chemie International Edition. 1968, s. 467–468. doi:10.1002/anie.196804672.
- ↑ Wolfgang A. Herrmann; Christian Zybill. Synthetic Methods of Organometallic and Inorganic Chemistry – Volume 1: Literature, Laboratory Techniques, and Common Starting Materials. [s.l.]: Georg Thieme Verlag, 1996. ISBN 9783131791610. Kapitola Bis{(μ-chloro)[chloro(η-pentamethylcyclopentadienyl)rhodium]} — {Rh(μ-Cl)Cl[η-C5(CH3)5]}2, s. 148–149.
- ↑ a b Richard F. Heck. Organotransition Metal Chemistry: A Mechanistic Approach. [s.l.]: Academic Press, 1974. Dostupné online. ISBN 9780323154703. Kapitola Reactions of Dienes Trienes and Tetraenes with Transition Metal Compounds, s. 116-117.
- ↑ Jung W. Kang; K. Moseley; Peter M. Maitlis. Pentamethylcyclopentadienylrhodium and -iridium halides. I. Synthesis and properties. Journal of the American Chemical Society. 1969, s. 5970–5977. doi:10.1021/ja01050a008.
- ↑ J. W. Kang; K. Moseley; Peter M. Maitlis. Mechanisms of Reactions of Dewar Hexamethylbenzene with Rhodium and Iridium Chlorides. Chemical Communications. 1968, s. 1304–1305. doi:10.1039/C19680001304.
- ↑ J. W. Kang; Peter M. Maitlis. Conversion of Dewar Hexamethylbenzene to Pentamethylcyclopentadienylrhodium(III) Chloride. Journal of the American Chemical Society. 1968, s. 3259–3261. doi:10.1021/ja01014a063.
- ↑ Wolfgang A. Herrmann; Christian Zybill. Synthetic Methods of Organometallic and Inorganic Chemistry – Volume 1: Literature, Laboratory Techniques, and Common Starting Materials. [s.l.]: Georg Thieme Verlag, 1996. ISBN 9783131791610. Kapitola Dicarbonyl(η-pentamethylcyclopentadienyl)rhodium — Rh[η-C5(CH3)5](CO)2, s. 147–148.
- ↑ a b KING, R. B.; DOUGLAS, W. M.; EFRATY, A. 5-Acetyl-1,2,3,4,5-pentamethylcyclopentadiene. Org. Synth.. 1977. Dostupné online. doi:10.15227/orgsyn.056.0001.; Coll. Vol.. S. 39.
- ↑ Hans-Nikolaus Junkerg; Wolfgang Schäfer; Hans Niedenbrück. Oxydationsreaktionen mit Hexamethyl-bicyclo[2.2.0]-hexadien-(2.5) (= Hexamethyl-Dewar-Benzol). Chemische Berichte. 1967, s. 2508–2514. doi:10.1002/cber.19671000807.
- ↑ a b Amalia Asouti; Lazaros P. Hadjiarapoglou. Regioselective and diastereoselective dimethyldioxirane epoxidation of substituted norbornenes and hexamethyl Dewar benzene. Tetrahedron Letters. 2000, s. 539–542. doi:10.1016/S0040-4039(99)02113-9.
- ↑ Hepke Hogeveen; Peter W. Kwant. Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕. Tetrahedron Letters. 1973, s. 1665–1670. doi:10.1016/S0040-4039(01)96023-X.
-
↑ a b c d Moritz Malischewski; Konrad Seppelt. Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3) 2+
6 . Angewandte Chemie International Edition. 2016, s. 368–370. doi:10.1002/anie.201608795. PMID 27885766. - ↑ Leo A. Paquette; Grant R. Krow; J. Martin Bollinger; George A. Olah. Protonation of hexamethyl Dewar benzene and hexamethylprismane in fluorosulfuric acid – antimony pentafluoride – sulfur dioxide. Journal of the American Chemical Society. 1968, s. 7147–7149. doi:10.1021/ja01027a060.
- ↑ a b Steven M. Bachrach. A six-coordinate carbon atom [online]. 2017-01-17 [cit. 2017-01-18]. Dostupné online.
- ↑ Hepke Hogeveen; Peter W. Kwant. Pyramidal mono- and dications. Bridge between organic and organometallic chemistry. Accounts of Chemical Research. 1975, s. 413–420. doi:10.1021/ar50096a004.
- ↑ Arne Haaland; Svein Samdal; Ragnhild Seip. The molecular structure of monomeric methyl(cyclopentadienyl)zinc, (CH3)Zn(η-C5H5), determined by gas phase electron diffraction. Journal of Organometallic Chemistry. 1978, s. 187–192. doi:10.1016/S0022-328X(00)85041-X.
- ↑ Christoph Elschenbroich. Organometallics. [s.l.]: John Wiley & Sons, 2006. doi:isbn = 9783527805143. Kapitola Organometallic Compounds of Groups 2 and 12, s. 59–85.



![Trojrozměrný model přesmyknutého pentagonálně bipyramidálního dikationtu[21]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1f/C6%28CH3%296%282%2B%29_3D_skeletal.png/120px-C6%28CH3%296%282%2B%29_3D_skeletal.png)
