Vodný roztok
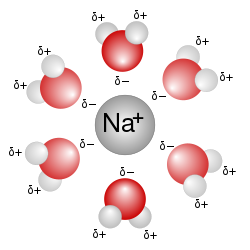
Vodný roztok je roztok využívající jako rozpouštědlo vodu. Látky ve vodném roztoku se v chemických roztocích značí symbolem (aq) za chemickým vzorcem, například Na+(aq) + Cl−(aq) pro roztok chloridu sodného (NaCl). Protože je voda často používaným rozpouštědlem, tak značení roztok označuje vodný roztok, není-li uvedeno jiné rozpouštědlo.[1][2]
Vlastnosti
Hydrofobní látky se ve vodě rozpouštějí obtížně, zatímco hydrofilní (například chlorid sodný) snadno.
Ve vodných roztocích jsou sodíkové kationty (H+) a hydroxidové anionty (OH−) v rovnováze podle rovnice [H+] [OH−] = Kw = 1 × 10−14 (při 298 K).
Arrheniova teorie definuje kyseliny a zásady ve vodných roztocích.[3] Arrheniovy kyseliny, například kyselina chlorovodíková (HCl), uvolňují ve vodných roztocích vodíkové kationty, Arrheniovy zásady, jako je hydroxid sodný (NaOH) uvolňují hydroxidové anionty.[1]
Vodné roztoky mohou obsahovat hydratované atomy vodíku a hydratované elektrony.
Elektrolyty
Vodné roztoky, které jsou dobrými vodiči elektrického proudu, obsahují „silné“ elektrolyty, v méně vodivých jsou přítomny slabší elektrolyty. Silné elektrolyty jsou v roztocích zcela nebo z velké části ionizované, zatímco u slabých je míra ionizace nízká.[3]
Neelektrolyty při rozpouštění ve vodě neuvolňují ionty; takovými látkami jsou například cukr, močovina, a glycerol.
Reakce
Častými reakcemi ve vodných roztocích jsou podvojné záměny, kdy kationty vytvářejí iontové vazby s jinými anionty.[3] Příkladem mohou být srážecí reakce, kdy je produktem nerozpustná pevná látka. Rozpustnost látky ve vodě určuje její schopnost překonat přitažlivé dipólové síly mezi molekulami vody. Pokud se látka nerozpustí, tak vytvoří sraženinu.[1]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Aqueous solution na anglické Wikipedii.
- ↑ a b c Peter Atkins. Chemical Principles: The Quest for Insight. [s.l.]: W. H. Freeman and Company, 2004-03-19. Dostupné online. ISBN 0-7167-5701-X. S. F61–F64.
- ↑ What Is an Aqueous Solution? Chemistry Definition and Example [online]. [cit. 2024-08-24]. Dostupné online.
- ↑ a b c Steven Zumdahl. Chemistry. [s.l.]: Houghton Mifflin, 1997. ISBN 9780669417944. S. 133–145.
Související články
- Acidobazická reakce
- Kyselostní funkce
- Disociace
- Rozpustnost
- Solvatovaný elektron

