Organokatalýza

V organické chemii je organokatalýza formou katalýzy, při níž se rychlost chemické reakce zvyšuje pomocí organického katalyzátoru. Tento „organokatalyzátor“ se skládá z uhlíku, vodíku, síry a dalších nekovových prvků, které se vyskytují v organických sloučeninách.[3][4][5][6][7][8] Vzhledem k podobnosti jejich složení a popisu jsou často mylně zaměňovány za enzymy, a to kvůli srovnatelnému vlivu na rychlost reakce a zapojeným formám katalýzy.
Organokatalyzátory, které vykazují sekundární aminovou funkčnost, lze popsat jako katalyzátory provádějící buď enaminovou katalýzu (tvorbou katalytického množství aktivního enaminového nukleofilu), nebo iminiovou katalýzu (tvorbou katalytického množství aktivovaného iminiového elektrofilu). Tento mechanismus je typický pro kovalentní organokatalýzu. Kovalentní vazba substrátu obvykle vyžaduje vysoké zatížení katalyzátoru. Nekovalentní interakce, jako je vodíková vazba, umožňují nízké zatížení katalyzátoru.
Organokatalýza nabízí několik výhod. Není potřeba katalýza na bázi kovů, což přispívá k zelené chemii. V této souvislosti byly jednoduché organické kyseliny použity jako katalyzátor pro modifikaci celulózy ve vodě v mnohatunovém měřítku.[9] Pokud je organokatalyzátor chirální, otevírá se cesta k asymetrické katalýze; příkladem chirality a zelené chemie je například použití prolinu v aldolových reakcích.[10] Organičtí chemici David MacMillan a Benjamin List získali v roce 2021 Nobelovu cenu za chemii za práci v oblasti asymetrické organokatalýzy.[11]
Úvod
Běžné achirální organokatalyzátory jsou založeny na dusíku, jako je piperidin používaný při Knoevenagelově kondenzaci.[12]DMAP používaný při esterifikacích[13] a DABCO používaný v Baylisově-Hillmanově reakci.[14]Thiazoliové soli se používají ve Stetterově reakci. Tyto katalyzátory a reakce mají dlouhou historii, ale současný zájem o organokatalýzu je zaměřen na asymetrickou katalýzu s chirálními katalyzátory, tzv. asymetrickou organokatalýzu nebo enantioselektivní organokatalýzu. Průkopnická reakce vyvinutá v 70. letech 20. století se nazývá Hajosova–Parrishova–Ederova–Sauerova–Wiechertova reakce. V letech 1968-1997 se objevilo jen několik zpráv o použití malých organických molekul jako katalyzátorů pro asymetrické reakce (nejznámější je pravděpodobně Hajosova-Parrishova reakce), ale tyto chemické studie byly považovány spíše za jedinečné chemické reakce než za integrální součást většího, vzájemně propojeného oboru.[15]
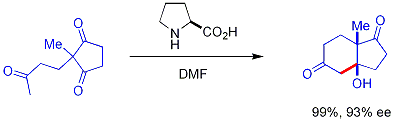
V této reakci je přirozeně se vyskytující chirální prolin chirálním katalyzátorem v aldolové reakci. Výchozím materiálem je achirální triketon a k získání reakčního produktu, ketolu v 93% enantiomerním přebytku, je zapotřebí pouze 3 % prolinu. Jedná se o první příklad asymetrické aldolové reakce katalyzované aminokyselinou.[16][17]
Asymetrická syntéza Wielandova–Miescherova ketonu (1985) je rovněž založena na prolinu a další brzkou aplikací byla jedna z transformací v totální syntéze erytromycinu Roberta B. Woodwarda (1981).[18] Článek se zaměřuje na vybrané nedávné příklady totální syntézy přírodních a farmaceutických produktů pomocí organokatalytických reakcí.[19]
Mnoho chirálních organokatalyzátorů je adaptací chirálních ligandů (které spolu s kovovým centrem rovněž katalyzují asymetrické reakce) a oba koncepty se do jisté míry překrývají.
Průlom v oblasti organokatalýzy nastal v roce 1997, kdy I-an Š' oznámil první obecnou, vysoce enantioselektivní organokatalytickou reakci s katalytickou asymetrickou epoxidací trans- a trisubstituovaných olefinů s chirálními dioxirany.[20] Od té doby bylo vyvinuto několik různých typů reakcí.
Třídy organokatalyzátorů
Organokatalyzátory pro asymetrickou syntézu lze rozdělit do několika tříd:
- Biomolekuly: prolin, fenylalanin, sekundární aminy obecně,[21]alkaloidy z chinovníku, a některé oligopeptidy.
- Syntetické katalyzátory odvozené z biomolekul.
- Katalyzátory vodíkové vazby, včetně TADDOLů, derivátů BINOLu, jako je NOBIN, a organokatalyzátorů na bázi thiomočoviny.
- Triazoliové soli jako katalyzátory Stetterovy reakce nové generace
Příklady asymetrických reakcí za účasti organokatalyzátorů jsou:
Prolin
Prolinová katalýza byla přezkoumána.[22][23]
Imidazolidinonová organokatalýza
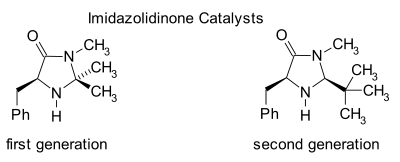
Imidazolidinony jsou katalyzátory mnoha transformací, jako jsou asymetrické Dielsovy-Alderovy reakce a Michaelovy adice. Chirální katalyzátory vyvolávají asymetrické reakce, často s vysokou enantioselektivitou. Tento katalyzátor funguje tak, že vytváří iminiový ion s karbonylovými skupinami α,β-nenasycených aldehydů (enalů) a enonů v rychlé chemické rovnováze. Tato aktivace iminia je podobná aktivaci karbonylových skupin Lewisovou kyselinou a oba katalyzátory snižují LUMO substrátu:[24][25]
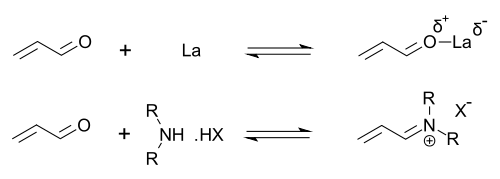
Přechodný iminiový meziprodukt je chirální, což se přenáší na reakční produkt prostřednictvím chirální indukce. Katalyzátory byly použity v Dielsových-Alderových reakcích, Michaelových adicích, Friedelových-Craftsových alkylacích, transferových hydrogenacích a epoxidacích.
Jedním z příkladů je asymetrická syntéza léčiva warfarinu (v rovnováze s hemiketalem) Michaelovou adicí 4-hydroxykumarinu a benzylidenacetonu:[26]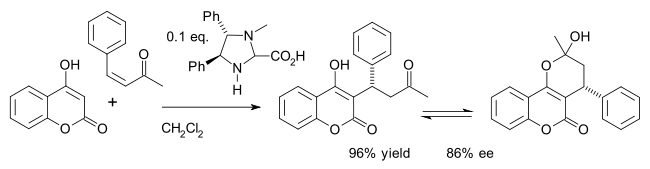
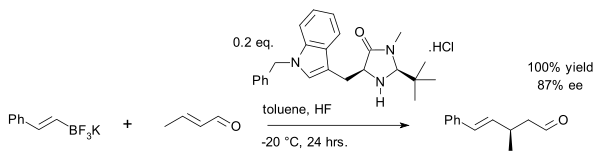
Byla využita vinylalkylace krotonaldehydu pomocí organotrifluorboritanu:[27]
Organokatalýza thiomočoviny
Velká skupina organokatalyzátorů obsahuje močovinu nebo thiomočovinu. Tyto katalyticky účinné (thio)močovinové deriváty označované jako (thio)močovinové organokatalyzátory poskytují explicitní dvojité vodíkové vazebné interakce pro koordinaci a aktivaci substrátů přijímajících H-vazby.[28]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Organocatalysis na anglické Wikipedii.
- ↑ LIEBIG, Justus von. Ueber die Bildung des Oxamids aus Cyan. Annalen der Chemie und Pharmacie. Roč. 113, čís. 2, s. 246–247. Dostupné online. DOI 10.1002/jlac.18601130213. (německy)
- ↑ LANGENBECK, W. Über organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden. Liebigs Ann. Roč. 469, s. 16–25. DOI 10.1002/jlac.19294690103. (německy)
- ↑ BERKESSEL, A.; GROEGER, H. Asymmetric Organocatalysis. Weinheim: Wiley-VCH, 2005. ISBN 978-3-527-30517-9.
- ↑ LIST, Benjamin. Organocatalysis. Chemical Reviews. 2007-12-12, roč. 107, čís. 12, s. 5413–5883. DOI 10.1021/cr078412e.
- ↑ DALKO, Peter I.; MOISAN, Lionel. In the Golden Age of Organocatalysis. Angew. Chem. Int. Ed.. 2004-09-24, roč. 43, čís. 39, s. 5138–5175. DOI 10.1002/anie.200400650. PMID 15455437.
- ↑ GAUNT, Matthew J.; CARIN, C. C.; JOHANSSON, Andy McNally, T. Vo Ngoc. Enantioselective organocatalysis. Drug Discovery Today. Roč. 12, čís. 1/2, s. 8–27. DOI 10.1016/j.drudis.2006.11.004. PMID 17198969.
- ↑ ENDERS, Dieter; GRONDAL, Christoph; HÜTTL, Matthias R. M. Asymmetric Organocatalytic Domino Reactions. Angew. Chem. Int. Ed.. 2007-02-19, roč. 46, čís. 10, s. 1570–1581. DOI 10.1002/anie.200603129. PMID 17225236.
- ↑ DALKO, Peter I.; MOISAN, Lionel. Enantioselective Organocatalysis. Angew. Chem. Int. Ed.. 2001-10-10, roč. 40, čís. 20, s. 3726–3748. DOI 10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D.
- ↑ International Patent WO 2006068611 A1 20060629 Direct Homogeneous and Heterogeneous Organic Acid and Amino Acid-Catalyzed Modification of Amines and Alcohols [online]. [cit. 2022-06-18].
- ↑ HAJOS, Zoltan G.; PARRISH, David R. U.S. Patent 3,975,440 [online]. [cit. 2022-06-18].
- ↑ The Nobel Prize in Chemistry 2021 [online]. [cit. 2022-06-18]. Dostupné online.
- ↑ LIST, Benjamin. Emil Knoevenagel and the Roots of Aminocatalysis. Angewandte Chemie International Edition in English. Roč. 49, čís. 10, s. 1730–1734. DOI 10.1002/anie.200906900. PMID 20175175.
- ↑ NEISES, Bernhard; STEGLICH, Wolfgang. Simple Method for the Esterification of Carboxylic Acids. Angewandte Chemie International Edition in English. Roč. 17, čís. 7, s. 522–524. DOI 10.1002/anie.197805221.
- ↑ BASAVAIAH, Deevi; RAO, Anumolu Jaganmohan; SATYANARAYANA, Tummanapalli. Recent Advances in the Baylis−Hillman Reaction and Applications. Chemical Reviews. Roč. 103, čís. 3, s. 811–892. DOI 10.1021/cr010043d. PMID 12630854.
- ↑ MACMILLAN, David W. C. The advent and development of organocatalysis. Nature. Springer Science and Business Media LLC, 2008-09-17, roč. 455, čís. 7211, s. 304–308. ISSN 0028-0836. DOI 10.1038/nature07367. PMID 18800128.
- ↑ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 1971
- ↑ HAJOS, Zoltan G.; PARRISH, David R. Asymmetric synthesis of bicyclic intermediates of natural product chemistry. The Journal of Organic Chemistry. Roč. 39, čís. 12, s. 1615–1621. DOI 10.1021/jo00925a003.
- ↑ WOODWARD, R. B.; LOGUSCH, E.; NAMBIAR, K. P., K. Sakan, D. E. Ward, B. W. Au-Yeung, P. Balaram, L. J. Browne. Asymmetric total synthesis of erythromcin. 1. Synthesis of an erythronolide A secoacid derivative via asymmetric induction. Journal of the American Chemical Society. Roč. 103, čís. 11, s. 3210–3213. DOI 10.1021/ja00401a049.
- ↑ SUN, B. F. Total synthesis of natural and pharmaceutical products powered by organocatalytic reactions. Tetrahedron Lett. Roč. 56, čís. 17, s. 2133–2140. Dostupné online. DOI 10.1016/j.tetlet.2015.03.046.
- ↑ WANG, Zhi-Xian; TU, Yong; FROHN, Michael, Jian-Rong Zhang, Yian Shi. An Efficient Catalytic Asymmetric Epoxidation Method. S. 11224–11235. Journal of the American Chemical Society [online]. [cit. 2022-06-18]. S. 11224–11235. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja972272g.
- ↑ BERTELSEN, Søren. Organocatalysis—after the gold rush. Chemical Society Reviews. Roč. 38, čís. 8, s. 2178–89. DOI 10.1039/b903816g. PMID 19623342.
- ↑ GAUNT, M. J.; JOHANSSON, C. C. C.; MCNALLY, A., N. T. Vo. Enantioselective organocatalysis". Drug Discovery Today. Drug Discovery Today. Roč. 12, čís. 1/2, s. 8–27. DOI 10.1016/j.drudis.2006.11.004. PMID 17198969.
- ↑ KUCHERENKO, A. S.; SIYUTKIN, D. E.; MALTSEV, O. V., S. V. Kochetkov, S. G. Zlotin. Asymmetric organocatalysis: From proline to highly efficient immobilized organocatalysts. Russian Chemical Bulletin. Roč. 61, čís. 7, s. 1313. DOI 10.1007/s11172-012-0177-4.
- ↑ LELAIS, Gerald; MACMILLAN, David W. C. Modern Strategies in Organic Catalysis: The Advent and Development of Iminium Activation. Aldrichimica Acta. Roč. 39, čís. 3, s. 79. Dostupné online.[nedostupný zdroj]
- ↑ ERKKILÄ, Anniinä; MAJANDER, Inkeri; PIKHO, Petri M. Iminium Catalysis. Chem. Rev.. Roč. 107, čís. 12, s. 5416–5470. DOI 10.1021/cr068388p. PMID 18072802.
- ↑ HAALAND, Nis; HANSEN, Tore; JØRGENSEN, Karl Anker. Organocatalytic Asymmetric Michael Reaction of Cyclic 1,3-Dicarbonyl Compounds and α,β-Unsaturated Ketones – A Highly Atom-Economic Catalytic One-Step Formation of Optically Active Warfarin Anticoagulant. Angew. Chem. Int. Ed.. Roč. 42, čís. 40, s. 4955–4957. DOI 10.1002/anie.200352136. PMID 14579449.
- ↑ LEE, Sandra; MACMILLAN, David W. C. Organocatalytic Vinyl and Friedel-Crafts Alkylations with Trifluoroborate Salts. J. Am. Chem. Soc.. Roč. 129, čís. 50, s. 15438–15439. DOI 10.1021/ja0767480. PMID 1803104.
- ↑ MADARÁSZ, Ádám; DÓSA, Zsolt; VARGA, Szilárd, Tibor Soós, Antal Csámpai, Imre Pápai. Thiourea Derivatives as Brønsted Acid Organocatalysts. ACS Catalysis. Roč. 6, čís. 7, s. 4379–4387. Dostupné online. DOI 10.1021/acscatal.6b00618.
Externí odkazy
- Obrázky, zvuky či videa k tématu organokatalýza na Wikimedia Commons

