Bürgiův–Dunitzův úhel

Bürgiův–Dunitzův úhel (BD úhel) je jedním ze dvou úhlů, které popisují geometrii přiblížení nukleofilu k trigonálnímu nenasycenému centru molekuly; původně byla uvažována karbonylová centra ketonů, později byl tento koncept použit také na aldehydy, estery, amidy, a alkeny.[1][2][3] Úhel má název podle krystalografů Hanse-Beata Bürgiho a Jacka D. Dunitze, kteří se jim jako první zabývali.
Bürgiův–Dunitzův a Flippinův–Lodgeův úhel se staly důležitými pro porozumění enantioselektivním syntézám, obzvláště pak asymetrické indukci během nukleofilních ataků na stíněných karbonylech.[4][5]
Stereoelektronové jevy které způsobují, že se nukleofily přibližují v určitých rozmezích Bürgiových–Dunitzových úhlů, mohou mít vliv na konformační stabilitu bílkovin[6][7] a s jejich zahrnutím lze vysvětlit stabilitu jednotlivých konformací molekul podle jedné z hypotéz zapojených do chemického vzniku života.[8]
Definice
Při reakci nukleofilu (Nu) s karbonylem se Bürgiův–Dunitzův úhel definuje jako vazebný úhel Nu-C-O. Při přibližování nukleofilu k trigonálnímu nenasycenému elektrofilu závisí převážně na tvarech molekulových orbitalů a zaplněnosti karbonylového centra, vliv molekulových orbitalů nukleofilu je menší.[1]
Druhý z dvojice úhlů definujících geometrii nukleofilního ataku popisuje přístup nukleofilu k jednomu ze dvou substituentů navázaných na karbonylový uhlík nebo jiné elektrofilní centrum a nazývá se Flippinův–Lodgeův úhel podle Lee A. Flippina a Erica P. Lodge.[4]
Měření
Původní Bürgiova-Dunitzova měření byla založena na vnitromolekulárních interakcích mezi aminy a ketony v krystalech sloučenin obsahujících obě tyto skupiny, jako jsou metadon a protopin. BD úhly se u nich pohybují v úzkém rozmezí (105 ± 5°); pozdější výpočty přiblížení orbitalu s hydridového aniontu (H−) k pí-systému nejjednoduššího aldehydu, formaldehydu (H2C=O), daly údaj 107°.[2]
-
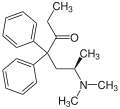 Struktura L-metadonu.
Struktura L-metadonu. -
 Struktura protopinu
Struktura protopinu -
![Amin-karbonylové interakce n→π* u protopinu, s neobvykle krátkými vzdálenostmi N···C 255,5 pm a Bürgiovým–Dunitzovým úhlem 102°.[9]](//upload.wikimedia.org/wikipedia/commons/thumb/7/74/Protopine-from-xtal-B%C3%BCrgi-Dunitz-Mercury-3D-stick-bs.png/120px-Protopine-from-xtal-B%C3%BCrgi-Dunitz-Mercury-3D-stick-bs.png) Amin-karbonylové interakce n→π* u protopinu, s neobvykle krátkými vzdálenostmi N···C 255,5 pm a Bürgiovým–Dunitzovým úhlem 102°.[9]
Amin-karbonylové interakce n→π* u protopinu, s neobvykle krátkými vzdálenostmi N···C 255,5 pm a Bürgiovým–Dunitzovým úhlem 102°.[9]
Teorie
Pozorované velikosti BD úhlů jsou následky maximalizování překryvu nejvyššího obsazeného molekulového orbitalu (HOMO) nukleofilu a nejnižšího neobsazeného molekulového orbitalu (LUMO) nenasyceného trigonálního centra elektrofilu.[1]
- Adice hydridu na formaldehyd
-
 Odhadovaná Bürgiův–Dunitzův úhel u nejjednodušší nukleofilní adice, H(–) → H2C=O
Odhadovaná Bürgiův–Dunitzův úhel u nejjednodušší nukleofilní adice, H(–) → H2C=O -
 Interakce mezi HOMO a LUMO ovlivňující velikost Bürgiova–Dunitzova úhlu
Interakce mezi HOMO a LUMO ovlivňující velikost Bürgiova–Dunitzova úhlu
(vlevo) Atak nabitého nukleofilu (Nu), v podobě hydridového aniontu, na trigonální centrum formaldehydu (R,R'=H), sloužícího jako elektrofil. Vyznačen je také Bürgiův–Dunitzův úhel pro tuto reakci, mající hodnotu 107°, o tupý úhel jde také u většiny ostatních reakcí.
(vpravo) Znázornění přiblížení nejvyššího obsazeného orbitalu (HOMO) typu p v molekule nukleofilu, například chloridového iontu (zelená koule), a nejnižšího neobsazeného orbitalu (LUMO) trigonálního centra elektrofilní karbonylové skupiny formaldehydu (černá koule = uhlík, červená koule = kyslík, bílé koule = atomy vodíku). Vychýlení karbonylového uhlíku mimo rovinu není, pro zjednodušení, zobrazeno.
Při adicích na karbonyly je HOMO často orbital typu (například u aminového dusíku nebo u aniontu halogenidu) a roli LUMO mívá protivazebný orbital π* kolmý na rovinu, v níž leží vazba C=O a její substituenty. O Bürgiově–Dunitzově úhlu zjištěném u nukleofilního ataku se předpokládá, že jde o úhel, při kterém nastává nejlepší možný překryv HOMO a LUMO. Nukleofil přitom brání překryvům s dalšími orbitaly elektrofilní skupiny, které jsou pro vznik vazby nevýhodné.
Doplnění modelu
Elektrostatické a Van der Waalsovy síly
K vytváření modelů skutečných chemických reakcí se do modelu obsahujícího HOMO a LUMO přidává další komplex, jenž zahrnuje odpudivé síly vytvářené elektrofilem a přitažlivé elektrostatické a Van der Waalsovy síly, jež mají také vliv na velikost BD úhlu a Flippinova-Lodgeova úhlu (viz obrázky nahoře).[10]
Lineární a rotační dynamika
Teorie BD úhlu byla vyvinuta na základě „zamrzlých“ interakcí v krystalech, kde lze dynamické vlivy (například změny torzních úhlů) zanedbat; většina prakticky využívaných reakcí ovšem probíhá skrz srážky molekul.
Vliv prostředí u enzymů a nanomateriálů
V omezených prostředích, jako jsou enzymy a vazebná místa nanomaterálů se mohou BD úhly výrazně lišit, protože modely reaktivity založené na překryvech orbitalů během náhodných srážek zde nelze použít.[11][12]
Hodnota BD pro štěpení amidu serinovou proteázou subtilisinem má hodnotu 88°, výrazně odlišnou od té při reakci hydridu a formaldehydu (107°); u téže reakce s jinými katalyzátory se velikosti Bürgiových–Dunitzových úhlů 89 pohybovaly v rozmezí 89 ± 7°. Flippinův–Lodgeův úhel pro subtilisin činil 8°, s různými katalyzátory se pohybovaly v rozmezí 4 ± 6°.[12]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Bürgi–Dunitz angle na anglické Wikipedii.
- ↑ a b c Fleming, I. (2010) Molecular Orbitals and Organic Chemical Reactions: Reference Edition, John Wiley & Sons, pp. 214–215
- ↑ a b H.-B. Bürgi; J. D. Dunitz; J.-M. Lehn; G. Wipff. Stereochemistry of reaction paths at carbonyl centres. Tetrahedron. 1974, s. 1563–1572. doi:10.1016/S0040-4020(01)90678-7.
- ↑ Cieplak, A.S. (2008) Organic addition and elimination reactions: Transformation paths of carbonyl derivatives, Structure Correlation, Vol. 1 (H.-B. Bürgi & J. D. Dunitz, eds.), New York:John Wiley & Sons, pp. 205–302, esp. 216-218 [doi:10.1002/9783527616091.ch06; ISBN 9783527616091]
- ↑ a b Heathcock, C.H. (1990) Understanding and controlling diastereofacial selectivity in carbon-carbon bond-forming reactions, Aldrichimica Acta 23(4):94-111, esp. p. 101 Archivováno 6. 1. 2014 na Wayback Machine.
- ↑ Gawley, R.E. & Aube, J. 1996, Principles of Asymmetric Synthesis (Tetrahedron Organic Chemistry Series, Vo. 14), pp. 121-130, esp. pp. 127f
- ↑ G. J. Bartlett; A. Choudhary; R. T. Raines; D. N. Woolfson. n→π* interactions in proteins. Nature Chemical Biology. 2010, s. 615–620. doi:10.1038/nchembio.406. PMID 20622857.
- ↑ C. Fufezan. The role of Buergi‐Dunitz interactions in the structural stability of proteins. Proteins. 2010, s. 2831–2838. doi:10.1002/prot.22800. PMID 20635415.
- ↑ A. Choudhary; K. J. Kamer; M. W. Powner; J. D. Sutherland; R. T. Raines. A stereoelectronic effect in prebiotic nucleotide synthesis. ACS Chemical Biology. 2010, s. 655–657. doi:10.1021/cb100093g. PMID 20499895.
- ↑ S. R. Hally; F. R. Ahmed. The crystal structure of protopine, C20H19O5N. Acta Crystallographica Section B. 1968, s. 337–346. doi:10.1107/S0567740868002347.
- ↑ Lodge, E. P., Heathcock, C. H. (1987) Steric effects, as well as sigma*-orbital energies, are important in diastereoface differentiation in additions to chiral aldehydes, Journal of the American Chemical Society, 109:3353-3361
- ↑ Light, S.H.; Minasov, G.; Duban, M.-E. & Anderson, W.F. (2014) Adherence to Bürgi-Dunitz stereochemical principles requires significant structural rearrangements in Schiff-base formation: Insights from transaldolase complexes, Acta Crystallographica Section D 70(Pt 2):544-52, DOI: 10.1107/S1399004713030666
- ↑ a b RADISKY, Evette S.; KOSHLAND, Daniel E. A clogged gutter mechanism for protease inhibitors. Proceedings of the National Academy of Sciences. 2002-08-06, roč. 99, čís. 16, s. 10316–10321. Dostupné online [cit. 2025-05-01]. ISSN 0027-8424. doi:10.1073/pnas.112332899. PMID 12142461. (anglicky)
Související články
- Flippinův–Lodgeův úhel





![Amin-karbonylové interakce n→π* u protopinu, s neobvykle krátkými vzdálenostmi N···C 255,5 pm a Bürgiovým–Dunitzovým úhlem 102°.[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/74/Protopine-from-xtal-B%C3%BCrgi-Dunitz-Mercury-3D-stick-bs.png/120px-Protopine-from-xtal-B%C3%BCrgi-Dunitz-Mercury-3D-stick-bs.png)


