Alkylové komplexy přechodných kovů

Alkylové komplexy přechodných kovů jsou komplexní sloučeniny obsahující vazby mezi přechodnými kovy a alkylové ligandy; jedná se o širokou skupinu sloučenin, které mají i praktický a teoretický význam.[1][2]
Přehled
Většina alkylových komplexů obsahuje i nealkylové ligandy; předmětem výzkumu jsou především homoleptické (kde jsou všechny ligandy stejného druhu), prvním popsaným komplexem obsahujícím vazbu mezi kovem a sp3 uhlíkem byl homoleptický diethylzinek, k dalším případům patří hexamethylwolfram, tetramethyltitan, a tetranorbornylkobalt.[3]

Struktura diethylzinku; délka vazeb Zn-C činí 194,8(5) pm, úhel C-Zn-C je mírně narušený, s velikostí 176,2(4)°.[4]
Komplexy s ligandy více druhů (heteroleptické), zahrnující také alkyly, jsou například vitamin B12 a mnohé jeho deriváty, tyto sloučeniny mají vazby mezi alkylovými skupinami a Co.

Hexamethylwolfram patří mezi homoleptické alkylové komplexy.[3]
| příklad | poznámka |
|---|---|
| Ti(CH3)4 | pozorovaný pouze jako monoetherát, d0[5] |
| [Ti(CH3)5]− | trigonálně bipyramidální, d0[5] |
| [Ti2(CH3)9]− | jeden můstkový methylový ligand, d0,d0[5] |
| [Zr(CH3)6]− | trigonálně prizmatický, d0[6][5] |
| [Hf(CH3)6]− | trigonálně prizmatický, d0[6] |
| [Nb(CH3)6]− | d0[3][6] |
| [Ta(CH3)6]− | d0[3] |
| Mo(CH3)5 | d1[7] |
| W(CH3)6 | trigonálně prizmatický, d0[3] |
| [Mn(CH3)4]2− | d5[8] |
| [Mn(CH3)6]2− | d3[9] |
| [Re(CH3)6] | d1[3] |
| [Fe(CH3)4]− | nízkospinový, d5, čtvercově rovinný[10] |
| [Co(CH3)4]− | čtvercově rovinný, d6[11] |
| [Rh(CH3)6]3− | d6[12] |
| [Ir(CH3)6]3− | d6[12] |
| [Ni(CH3)4]2− | d8[13] |
| [Pt(CH3)4]2− | d8[14] |
| [Au(CH3)2]− | d10[15] |
| [Au(CH3)4]− | d8[15] |
| Zn(CH3)2 | d10 |
| Cd(CH3)2 | d10 |
| Hg(CH3)2 | d10 |
Příprava
Alkylové komplexy lze připravit jedním ze dvou způsobů, pomocí alkylových nukleofilů, nebo alkylových elektrofilů. K nukleofilním zdrojům alkylových ligandů patří Grignardova a organolithná činidla. Protože jsou mnohé silné nukleofily také silnými redukčními činidly, tak se někdy za účelem zamezení redoxním reakcím používají mírnější nukleofily, například organozinečnaté a organohlinité sloučeniny.
Při elektrofilních alkylacích se zpravidla začíná u komplexů kovů v nízkých oxidačních číslech, jako elektrofily nejčastěji slouží alkylhalogenidy. Jako příklad lze uvést přípravu methylovaného derivátu aniontu dimeru dikarbonylu cyklopentadienylželeza:[16]
- CpFe(CO)2Na + CH3I → CpFe(CO)2CH3 + NaI
Alkyly kovů se mnohdy připravují oxidačními adicemi,[2]
jako je reakce Vaskova komplexu s jodmethanem.

Agostické interakce a beta-hydridové eliminace
Některé alkyly kovů vykazují agostické interakce mezi vazbami C-H alkylových skupin a atomem kovu. Obzvláště rozšířené jsou tyto interakce u raných přechodných kovů ve svých nejvyšších oxidačních číslech.[18]
Na kinetickou stabilitu alkylových komplexů má významný vliv vodík v poloze beta vůči kovu. Pokud komplex obsahuje takový vodík a kovové centrum je koordinačně nenasycené, pak se u něj může objevit beta-hydridová eliminace, jejímž produktem je alkenový komplex:
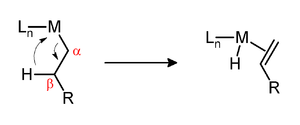
Na těchto přeměnách se podílí také agostické interakce.
Katalýza
Mnoho homogenních katalyzátorů vytváří při hydrogenačních, hydroformylačních, izomerizačních, a polymeračních reakcích jako meziprodukty alkyly kovů. Dočasná tvorba vazeb kov-alkyl se předpokládá i u heterogenních reakcí.[19]
Reference
V tomto článku byl použit překlad textu z článku Transition metal alkyl complexes na anglické Wikipedii.
- ↑ José Oliveira; Christoph Elschenbroich. Organometallics. Weinheim: Wiley-VCH, 2006. ISBN 978-3-527-29390-2.
- ↑ a b J. F. Hartwig. Organotransition Metal Chemistry, from Bonding to Catalysis. [s.l.]: University Science Books, 2010. ISBN 978-1-891389-53-5.
- ↑ a b c d e f S. Kleinhenz; V. Pfennig; K. Seppelt. Preparation and Structures of [W(CH3)6], [Re(CH3)6], [Nb(CH3)6]−, and [Ta(CH3)6]−. Chemistry – A European Journal. 1998, s. 1687–1691. DOI 10.1002/(SICI)1521-3765(19980904)4:9<1687::AID-CHEM1687>3.0.CO;2-R.
- ↑ John Bacsa; Felix Hanke; Sarah Hindley; Rajesh Odedra; George R. Darling; Anthony C. Jones; Alexander Steiner. The Solid State Structures of Dimethylzinc and Diethylzinc. Angewandte Chemie International Edition. 2011, s. 11685–11687. DOI 10.1002/anie.201105099. PMID 21919175.
- ↑ a b c d Sven Kleinhenz; Konrad Seppelt. Preparation and Structures of Methyltitanium Compounds. Chemistry - A European Journal. 1999, s. 3573–3580. DOI 10.1002/(SICI)1521-3765(19991203)5:12<3573::AID-CHEM3573>3.3.CO;2-F.
- ↑ a b c Paige M. Morse; Gregory S. Girolami. Are d0 ML6 complexes always octahedral? The x-ray structure of trigonal-prismatic [Li(tmed)]2[ZrMe6]. Journal of the American Chemical Society. 1989, s. 4114–4116. DOI 10.1021/ja00193a061.
- ↑ Beatrice Roessler; Sven Kleinhenza; Konrad Seppelt. Pentamethylmolybdenum. Chemical Communications. 2000, s. 1039–1040. DOI 10.1021/ja00193a061.
- ↑ Robert J. Morris; Gregory S. Girolami. Permethylmanganates. Synthesis and characterization of divalent [MnMe42-], trivalent [MnMe52-], and tetravalent [MnMe62-]. Journal of the American Chemical Society. 1988, s. 6245–6246. DOI 10.1021/ja00226a049. PMID 22148809.
- ↑ Robert J. Morris; Gregory S. Girolami. High-valent organomanganese chemistry. 1. Synthesis and characterization of manganese(III) and -(IV) alkyls. Organometallics. 1991, s. 792–799. DOI 10.1021/om00049a047.
- ↑ Malik H. Al-Afyouni; Kathlyn L. Fillman; William W. Brennessel; Michael L. Neidig. Isolation and Characterization of a Tetramethyliron(III) Ferrate: An Intermediate in the Reduction Pathway of Ferric Salts with MeMg Br. Journal of the American Chemical Society. 2014, s. 15457–15460. DOI 10.1021/ja5080757. PMID 25333789.
- ↑ Stephanie H. Carpenter; William W. Brennessel; Michael L. Neidig. Isolation and Characterization of a Homoleptic Tetramethylcobalt(III) Distorted Square-Planar Complex. Organometallics. 2019, s. 3486–3489. DOI 10.1021/acs.organomet.9b00387.
- ↑ a b Robyn S. Hay-Motherwell; Geoffrey Wilkinson; Bilquis Hussain; Michael B. Hursthouse. Homoleptic methyl compounds of rhodium and iridium(III). X-Ray crystal structures of tetramethylethylenediamine lithium hexamethyl-rhodate(III) and -iridate(III). Journal of the Chemical Society, Chemical Communications. 1989, s. 1436. DOI 10.1039/C39890001436.
- ↑ Dirk Walther; Michael Stollenz; Helmar Görls. Dinuclear [RNi(oxam)NiR] Complexes (Oxam = N1,N2-bis(2-pyridylmethyl)-N3,N4-bis(2,4,6-trimethylphenyl)oxalamidinate; R = Me, Ph, C⋮CH, C⋮CPH): Reactions of the Methyl Complex and Formation of [Li(THF)]2Li2Ni2Me8 and [Li(THF)]4Ni2Me8. Organometallics. 2001, s. 4221. DOI 10.1021/om000960u.
- ↑ R. Wyrwa; H. Görls. Ungewöhnliche Molekülstrukturen für Platin(II)-at-Komplexe. Zeitschrift für Anorganische und Allgemeine Chemie. 1999, s. 1904–1907. DOI 10.1002/(SICI)1521-3749(199911)625:11<1904::AID-ZAAC1904>3.0.CO;2-2.
- ↑ a b Dunming Zhu; Sergey V. Lindeman; Jay K. Kochi. X-ray Crystal Structures and the Facile Oxidative (Au−C) Cleavage of the Dimethylaurate(I) and Tetramethylaurate(III) Homologues. Organometallics. 1999, s. 2241–2248. Dostupné online. DOI 10.1021/om990043s.
- ↑ B. King. Applications of Metal Carbonyl Anions in the Synthesis of Unusual Organometallic Compounds. Accounts of Chemical Research. 1970, s. 417–427. DOI 10.1021/ar50036a004.
- ↑ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams; T. F. Koetzle. Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R] (R = Et or Me). Journal of the Chemical Society, Dalton Transactions. 1986, s. 1629. Dostupné online. DOI 10.1039/dt9860001629.
- ↑ W. Scherer; G. S. McGrady. Agostic Interactions in d0 Metal Alkyl Complexes. Angewandte Chemie International Edition. 2004, s. 1782–1806. DOI 10.1002/anie.200200548. PMID 15054779.
- ↑ Jeffrey G. Forbes; Andrew J. Gellman. The beta-hydride elimination mechanism in adsorbed alkyl groups. Journal of the American Chemical Society. 1993, s. 6277–6283. ISSN 0002-7863. DOI 10.1021/ja00067a048.




